Стадия - обрыв
Cтраница 3
Можно представить, что подобные реакции протекают с участием отрицательных ионов. Общий механизм приводит к четкому распределению молекулярных весов [259]; вероятно, не существует никаких истинных стадий обрыва или инициирования. [31]
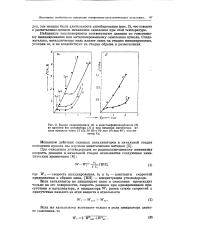 |
Выход гидроперекиси ( а и диметилфенилкарбинола ( б во времени без ингибитора ( 1 и при введении ингибитора по ходу процесса через 16 ( 2, 80 ( 3 и 60 мин ( 4 при 90. катализатор Си. [32] |
Найденные закономерности соответствуют данным по гомогенному инициированию или катализированному окислению кумола. Следовательно, металлическая медь влияет лишь на стадию инициирования, ускоряя ее, и не воздействует на стадии обрыва и разветвления. [33]
Однако поскольку акт стадии обрыва при поликонденсации мало отличается химически от акта стадии образования, то в рассматриваемом случае выводы относительно стадии обрыва можно распространить и на стадию роста. [35]
Хлорирование на насадке начинается при более низкой температуре и до 250 С протекает интенсивнее, чем в пустом объеме. С точки зрения цепного механизма объясняется это тем, что при сравнительно низких температурах увеличение поверхности приводит к большему ускорению стадии зарождения относительно стадии поверхностного обрыва. В условиях повышенных температур поверхность играет решающую роль в стадии обрыва и замедляет процесс. [36]
Наличие же в реакционной массе крупных ароматических молекул ускоряет процесс коксообразования вследствие реакции конденсации ( 14) и при взаимодействии ароматических молекул друг с другом или коксом. Образующиеся многоядерные карбоний-ионы чрезвычайно устойчивы и поэтому их дальнейший рост на поверхности может продолжаться сравнительно долгое время, прежде чем не произойдет вновь отщепление протона, необходимое для стадии обрыва реакции. [37]
Из трех основных элементарных стадий - инициирования, роста и обрыва цепи - самой медленной и энергоемкой является инициирование. Для ее начала требуется энергия активации 84 - 126 кДж / моль, что в 3 - 4 раза превышает энергию активации стадии роста цепи и почти в 10 раз энергию активации стадии обрыва. [38]
Можно предположить, что кислород присутствует в избытке. Почему стадия обрыва ( 4), которая включает в себя два радикала R-OO -, по-видимому, является гораздо более важной, чем альтернативные реакции обрыва цепи. [39]
Терминология, весьма облегчающая обсуждение, разработана по образцу терминологии свободно-радикальной полимеризации. Важное отличие ионных механизмов - наблюдаемое обычно отсутствие зависимости скорости реакции от квадратного корня из концентрации катализатора. Это приводит к допущению мономолекулярной стадии обрыва, хотя природа катализатора вследствие явления сокатализа не всегда определенно известна. Что касается стадии роста цепи, то тут сходство между свободнорадикальным и ионным механизмом совершенно очевидно. [40]
Реакция, в результате которой из активных интермедиатов стадии роста цепи образуются нереакционноспособные частицы, представляет собой стадию обрыва цепи. Существуют также и другие типы стадий обрыва, характерные для конкретных механизмов. [41]
Поскольку функция перекисного инициатора состоит в том, что он запускает эту последовательность свободнорадикальных реакций, то требуется лишь каталитическое количество этого вещества. Радикалы, ведущие цепной процесс, удаляются из реакции только в том случае, если они реагируют друг с другом, образуя молекулы с большим запасом энергии, которые сразу передают энергию какой-то третьей частице, или эти радикалы могут адсорбироваться на поверхности реакционного сосуда, или они могут реагировать с какой-нибудь примесью. Подобные процессы могут быть описаны как стадия обрыва всей цепной реакции, но до тех пор, пока в среде имеется ощутимая концентрация реагентов, подобные обрывы цепи будут случаться довольно редко. Конечно, поверхность реакционных сосудов может быть довольно велика, но частота столкновения в газе при атмосферном давлении равна примерно 108 столкновений в секунду. Следовательно, квантовый выход в цепных реакциях должен быть очень высоким. [42]
Поскольку функция перекисного инициатора состоит в том, что он запускает эту последовательность свободнорадикальных реакций, то требуется лишь каталитическое количество этого вещества. Радикалы, ведущие цепной процесс, удаляются из реакции только в том случае, если они реагируют друг с другом, образуя молекулы с большим запасом энергии, которые сразу передают энергию какой-то третьей частице, или эти радикалы могут адсорбироваться на поверхности реакционного сосуда, или они могут реагировать с какой-нибудь примесью. Подобные процессы могут быть описаны как стадия обрыва всей цепной реакции, но до тех пор, пока в среде имеется ощутимая концентрация реагентов, подобные обрывы4 цепи будут случаться довольно редко. Конечно, поверхность реакционных сосудов может быть довольно велика, но частота столкновения в газе при атмосферном давлении равна примерно 108 столкновений в секунду. Следовательно, квантовый выход в цепных реакциях должен быть очень высоким. [43]
Хлорирование на насадке начинается при более низкой температуре и до 250 С протекает интенсивнее, чем в пустом объеме. С точки зрения цепного механизма объясняется это тем, что при сравнительно низких температурах увеличение поверхности приводит к большему ускорению стадии зарождения относительно стадии поверхностного обрыва. В условиях повышенных температур поверхность играет решающую роль в стадии обрыва и замедляет процесс. [44]
При своем распаде этот инициатор образует два радикала, содержащих карбоксильную группу. Если этот инициатор используется в процессе полимеризации, при котором стадия обрыва не регулируется, то получается смесь различных молекул. Обрыв путем рекомбинации приводит к полимерным цепям с карбоксильными группами на обоих концах молекулы. [45]
Страницы: 1 2 3 4
