Ионный характер - связь
Cтраница 2
Ионный характер связи наиболее просто оценить при помощи дипольного момента связи. Например, дипольный момент молекулы НС1 равен 1 03 - 10 - 18 ед. [16]
Такой частично ионный характер связи О - Н ведет к тому, что атом водорода приобретает некоторый положительный заряд, а это позволяет электронам другого атома приблизиться к протону, если даже протон уже связан. Образуется вторая, более слабая связь. [17]
Увеличение ионного характера связи увеличивает теплоту образования молекулы. [18]
Значения ионного характера связи, определяемые из данных для разных атомов, заметно различаются. В IC1 предположение об отсутствии гибридизации дает меньшее расхождение двух значений /, чем предположение о 15 % - ной s / j - гибридизации. [19]
Увеличение ионного характера связи С - Li не имеет существенного значения. [20]
Степень ионного характера связи в оксианио-нах удается связать с ионным потенциалом гипотетического центрального иона. По мере повышения ионного потенциала центрального иона поляризация электронных облаков у атомов кислорода настолько увеличивается, что характер связи X - О меняется, становясь уже не чисто ионным, а в значительной мере ковалентным. Вместе с тем в других оксианионах, таких, как ( ВеО2 -) х и А1Оз -, связь X - О оказывается более ионной из-за низкого ионного потенциала гипотетического центрального иона. Существование последних маловероятно, а ионы Ве2 и А13 вполне реально существуют в твердых солях типа BeF2 и A1F3, а также в виде гидратированных ионов в растворах. [21]
Вследствие частично ионного характера связи действительные значения атомных радиусов могут быть приняты для кремния и кислорода равными приблизительно 0.9 - 1.0 и 0.6 - 0.7 А соответственно. [22]
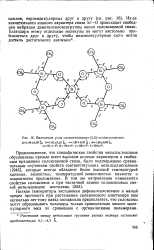 |
Валентные углы октаметилспиро - ( 5 5-пентасилоксана. [23] |
Из-за значительного ионного характера связи Si-О происходит свободная вибрация диметилсилоксигруппы около силоксановой связи. [24]
 |
Схема тетраэдрического. [25] |
Чтобы учесть ионный характер связи, необходимо дополнить исходную волновую функцию членом, соответствующим нахождению двух электронов на одном и том же атоме. [26]
Так как ионный характер связей N - О в конечном состоянии еще меньше, чем в переходном, то влияние заместителей на уровень конечного состояния должно быть меньше, чем на уровень переходного. [27]
Вещества с ионным характером связи при обычных условиях, как правило, являются твердыми, с высокими температура-ми плавления и кипения, расплавы этих соединений и растворы проводят электрический ток. Например, температура плавления NaCI равна 800 С, а температура кипения 1454 С. Эти свойства объясняются тем, что ионы в веществах типа поваренной соли NaCI сильно взаимодействуют друг с другом вследствие тою, что положительно заряженный ион натрия притягивает к себе отрицательно заряженный ион хлора. [28]
Соединения с сильно ионным характером связи типа калий-алкил очень реакционноспособны и воспламеняются на воздухе или при контакте с водой. Ртутьорганические соединения R-Hg-R, напротив, стабильны на воздухе, не реагируют с водой, растворимы в большинстве органических растворителей и очень токсичны. Все эти свойства делают ртутьорганические соединения весьма опасными для окружающей среды. Магнийорганические соединения типа RMgX довольно устойчивы и при этом обладают высокой реакционной способностью, что обусловливает их широкое применение в органическом синтезе. Виктор Гриньяр был удостоен Нобелевской премии по химии ( 1912) за создание и исследование данного класса соединений. [29]
Предположение о ионном характере связи в рассматриваемых молекулах позволяет понять принципы строения и более сложных, чемСзМО - э и Cs - SCb молекул. [30]
Страницы: 1 2 3 4