Ионный характер - связь
Cтраница 3
Подобно этому выражение ионный характер связи относится к дополнительному ионному характеру. [31]
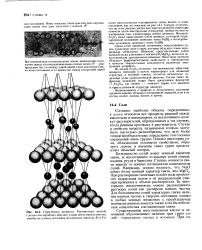 |
Структура шпинели. Расстояния между слоями кислородных атомов умышленно преувеличены, чтобы нагляднее показать положения атомов А1 и Fe. [32] |
Большинство солей имеет ионный характер связи, за исключением отдельных солей свинца, кадмия, ртути и бериллия. Степень ионности связи зависит от ионных потенциалов компонентов солей. При растворении типичных солей в воде происходит гидратация ионов и их распределение ( диспергирование) в объеме растворителя. [33]
Вычислено, что ионный характер связей в этих соединениях приблизительно тот же самый. [34]
Причиной этого является частично ионный характер связей в таких кристаллах. [36]
Считают, что ионный характер связи АВ зависит от разности электроотрицательностей двух атомов. Но количественная корреляция не существует даже с такими свойствами, как молекулярные дипольные моменты, для которых можно было бы ожидать четкого проявления этой корреляции. На рис. 4.2 приведены данные по дипольным моментам галоидоводородов. Видно, что для этого случая шкала Малликена в определенной степени оправданна, поскольку имеется корреляция дипольных моментов со значениями электроотрицательности по этой шкале. Однако такие корреляции существуют далеко не всегда. [37]
 |
Сдвиги, использованные для пересчетов. [38] |
Причины этого - частично ионный характер связей между центральным атомом и лигандами и наличие дативных я - связей ( гл. С увеличением формального заряда на атоме железа возрастает вероятность передачи этого электрического заряда на лиганды. Соответственно и электронные плотности на центральных атомах комплексных соединений не сильно различаются. Поэтому цианидные комплексные соединения [ Fe ( CN) 6 ] 4 - и [ Fe ( CN) e ] 3, в которых валентное состояние железа равно 2 и 3 соответственно, имеют очень близкие величины, изомерных сдвигов. Величины изомерных сдвигов, указанные на рис. 4.1, и все величины, приводимые в настоящей главе, даны относительно нитропруссида натрия Na2 [ Fe ( CN) 5NO ] 2Н2О как стандарта. [39]
Связь между долей ионного характера связи и разностью электроотрицательностей вытекает из самого существа представления об электроотрицательности. Дипольный момент ( в дебаях) связи АВ почти точно равен разности хд - хв. [40]
К определяет меру ионного характера связи и используется обычно как вариационный параметр. [41]
Я КР и ионным характером связи довольно трудно. Этот вопрос будет рассматриваться в разд. [42]
Следует отметить, что ионный характер связи должен увеличиваться в бесконечном кристалле по сравнению с двухатомной молекулой. В простой кубической решетке кристалла NaCl каждый атом натрия испытывает притяжение не менее шести атомов хлора, а каждый атом хлора - притяжение не менее шести атомов натрия. Отсюда следует, что единственный внешний электрон ( 3s) каждого из атомов Na должен, по-видимому, перейти на соседние атомы хлора и что по сравнению с молекулой ионный характер кристалла более выражен. [43]
Вполне возможно, что ионный характер связей достаточно велик для того, чтобы обеспечить также дальнейший перенос отрицательного заряда к атомам углерода, так что атом железа оказывается нейтральным или даже положительным. Структуры этого типа с частично двойными связями FeC, без сомнения, играют большую роль в основном состоянии комплексного иона, чем обычная структура А, приведенная в начале этого раздела. [44]
Термины существенно ковалентный и существенно ионный характер связи Паулинг [ P57J интерпретирует следующим образом. Связи между атомами большинства металлов и атомами кислорода, азота и хлора носят вследствие относительной электроотрицательности соответствующих атомов примерно на 50 / 0 ковалеитный характер. Наряду с постулатом об электронейтральности центрального атома это положение хорошо объясняет известное эмпирическое правило, согласно которому координационное число ионов металлов вдвое больше их положительного заряда. Таким образом, кобальт ( III) и хром ( III) образуют с кислородом оксалат-группы по 6 связей ( используя d spa гибридизованные орбиты) примерно на 50 / 0 ковалентного характера, так что центральный атом остается электрически нейтральным. В случае комплексов железа и алюминия для того, чтобы центральный атом остался электрически нейтральным, он должен образовать 4 связи ( используя имеющиеся s - и р-орбиты) примерно на 75 / 0 ковалентного характера и две чисто ионные связи. Связи между шестью кислородами оксалат-групп являются равноценными, причем каждая из них примерно на 50 / 0 является ковалентной. Таким образом, различие между типами оксалатных комплексов в случае кобальта ( III) и железа ( III) состоит не столько в различном характере связи в них, сколько в разной устойчивости этих комплексов, так как связи в обоих комплексах по своему характеру примерно наполовину ковалентны. [45]
Страницы: 1 2 3 4
