Хлорид - литий
Cтраница 1
 |
Термограммы с записью электропроводности для CaSCU 2Н2О ( а и ВаС12 2Н2О ( б. [1] |
Хлорид лития плавится при 103, при этом электропроводность резко возрастает. Образовавшийся ненасыщенный раствор закипает при 160, электропроводность при его кипении постепенно возрастает. К этому моменту электропроводность достигает предельного значения, а затем начинает уменьшаться. При полном выкипании насыщенного раствора происходит ее резкое падение. Совершенно аналогичные процессы происходят при нагревании других кристаллогидратов, плавящихся конгруэнтно. [2]
Хлорид лития ( а также и другие галогениды лития) адсорбирует в растворе и в сухом состоянии аммиак. Получены также многочисленные продукты присоединения органических аминов к хлориду лития. Как правило, к хлориду лития присоединяется только до-3 молекул, а иногда только 1 молекула органического амина. [3]
Хлорид лития ( а также и другие галогениды лития) адсорбирует в растворе и в сухом состоянии аммиак. Сухие соли в зависимости от температуры поглощают 1 - 4 молекулы NHs. Получены также многочисленные продукты присоединения органических аминов к хлориду лития. Как правило, к хлориду лития присоединяется только до 3 молекул, а иногда только 1 молекула органического амина. [4]
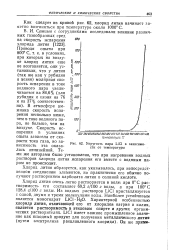 |
Упругость пара LiCl в зависимости от температуры. [5] |
Хлорид лития образуется, как указывалось, при непосредственном соединении элементов, но практически его обычно получают растворением карбоната лития в соляной кислоте. [6]
Хлорид лития очень легко растворяется в воде; при 0 С растворимость его составляет 69 2 г / 100 г воды, а при 100 С 128 4 г / 100 г воды. Из водных растворов LiCl кристаллизуется с одной, двумя и тремя молекулами воды. Характерной особенностью хлорида лития, отличающей его от хлоридов натрия и калия, является растворимость в этиловом спирте и других органических растворителях. [7]
Хлорид лития имеет почти однородную концентрацию, хотя она может слегка изменяться вблизи твердого хлорида таллия. [8]
Хлорид лития используется для электролиза в составе эвтектической смеси с КО. Ванной служит коробка ( 1220 X 1830 X 915 мм) из котельного железа, футерованная графитовыми блоками на углеродистом цементе. Снаружи она обложена огнеупорным кирпичом. [9]
Хлорид лития - LiCl, молекулярная масса 42 39 - белое кристаллическое вещество, соленое на вкус, весьма гигроскопичное. [10]
 |
Диаграмма плавкости системы LiCl-KCI. [11] |
Хлорид лития используют главным образом для промышленного получения лития электролизом расплава LiCl-KCI. В ограниченных масштабах применяют способ восстановления хлорида лития барием. Электролизом водных растворов хлорида лития получают гидроокись лития, которую используют для щелочных аккумуляторов. [12]
Хлорид лития является эффективным высаливающим и дегидратирующим агентом, что объясняется сильной гидратацией ионов лития. [13]
Хлорид лития был впервые выделен в 1853 г. при вскрытии литиевого минерала соляной кислотой. Для отделения LiCl от хлоридов натрия и калия была использована их различная растворимость в спирте и эфире. [14]
Хлорид лития может быть получен непосредственно из элементов. [15]
Страницы: 1 2 3 4