Суммарное число - электрон
Cтраница 3
Следует отметить, что между радиусами нейтральных атомов, положительных и отрицательных ионов имеет место следующее соотношение: радиус нейтрального атома больше радиуса положительного иона и меньше радиуса отрицательного иона. Это объясняется тем, что при отрыве от нейтрального атома электрона остающиеся электроны сильнее притягиваются к ядру атома, а потому радиус положительного иона уменьшается; при присоединении электрона к нейтральному атому суммарное число электронов становится больше заряда ядра и они притягиваются к последнему слабее, в результате чего радиус отрицательного иона увеличивается. [31]
Рентгеновское излучение возникает в том случае, если ближайший к ядру электрон выбивается из атома, а электрон, находившийся на более далеком расстоянии от ядра, занимает его место. При этом возникает излучение с частотой v, которое соответствует разности энергий этих двух электронных состояний. Очень важно то, что число рентгеновских серий значительно меньше суммарного числа электронов в атоме. Вероятнее всего, что в атоме всегда имеется несколько электронов, находящихся в приблизительно одинаковом энергетическом состоянии. Поэтому и возникло представление о том, что электроны в атоме распределены по оболочкам, причем все электроны каждой такой оболочки имеют одну и ту же энергию. Происхождение рентгеновских серий можно легко понять из рис. А. [32]
Общее число КВЭ вычисляют по след, схеме: к суммарному числу электронов валентных оболочек атомов металлов, образующих остов молекулы К. Металлоорганические соединения); для кластерных ионов прибавляется также заряд К. [33]
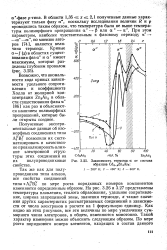 |
Зависимость термоэдс а от состава образцов Cd3 xZnxAs2. [34] |
Аз В по мере роста порядковых номеров компонентов изменяются определенным образом. На рис. 3.26 и 3.27 представлены температуры плавления, теплота образования, удельное сопротивление, ширина запрещенной зоны, значения термоэдс, а также значения других характеристик рассматриваемых соединений в зависимости от числа электронов в расчете на 1 формульную единицу. Как видно из этих рисунков, все эти величины по мере увеличения суммарного числа электронов, в общем, изменяются монотонно. [35]
Аз В - г по мере роста порядковых номеров компонентов изменяются определенным образом. На рис. 3.26 и 3.27 представлены температуры плавления, теплота образования, удельное сопротивление, ширина запрещенной зоны, значения термоэдс, а также значения других характеристик рассматриваемых соединений в зависимости от числа электронов в расчете на 1 формульную единицу. Как видно из этих рисунков, все эти величины по мере увеличения суммарного числа электронов, в общем, изменяются монотонно. [36]
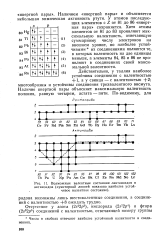 |
Возможные валентные состояния лантаноидов и актиноидов ( пунктирной линией показано наиболее устойчивое валентное состояние. [37] |
Наличием инертной пары и объясняется небольшая химическая активность ртути. У атомов последующих элементов с Z от 81 до 86 инертная пара сохраняется. Хотя атомы элементов от 81 до 83 проявляют максимальную валентность, отвечающую суммарному числу электронов на внешнем уровне, но наиболее устойчивыми их соединениями являются те, в которых валентность на две единицы меньше, а элементы 84, 85 и 86 не проявляют в соединениях своей максимальной валентности. [38]
На рис. III.24 схематически изображена система верхних энергетических уровней молекулы АВ, которая удовлетворяет следующим требованиям: 1) атом В более электроотрицателен, чем атом А, и 2) валентные оболочки обоих атомов состоят только из атомных s - и р-орбиталей. Анализ диаграмм на рис. II 1.22 ( молекулы А2) и рис. III.24 ( молекулы АВ) вскрывает их глубокую аналогию. Различие в электроотрицательности сводится к тому, что электроны связывающих орбиталеи проводят большую часть времени вблизи атома В; электронная плотность на разрыхляющих МО, наоборот, смещена в сторону атома А. Для использования диаграммы на рис. III.24 необходимо определить суммарное число электронов у атомов А и В и затем разместить их по молекулярным орбиталям. [39]
На рис. II 1.24 схематически изображена система верхних энергетических уровней молекулы АВ, которая удовлетворяет следующим требованиям: 1) атом В более электроотрицателен, чем атом А, и 2) валентные оболочки обоих атомов состоят только из атомных s - и р-орбиталей. Анализ диаграмм на рис. II 1.22 ( молекулы А2) и рис. III.24 ( молекулы АВ) вскрывает их глубокую аналогию. Различие в электроотрицательности сводится к тому, что электроны связывающих орбиталей проводят большую часть времени вблизи атома В; электронная плотность на разрыхляющих МО, наоборот, смещена в сторону атома А. Для использования диаграммы на рис. II 1.24 необходимо определить суммарное число электронов у атомов А и В и затем разместить их по молекулярным орбиталям. [40]
Метод МО представляет собой естественное распространение теории атомных орбиталей ( АО) на поведение электронов в молекуле. Предполагается, что электроны в молекуле находятся на молекулярных орбиталях, охватывающих все ядра атомов в молекуле, и МО занимает весь объем молекулы. Таким образом, метод МО рассматривает молекулу и другие устойчивые многоатомные системы как многоатомный атом, в котором электроны располагаются на орбиталях, называемых молекулярными. Так как на электрон молекулярной орбитали воздействует поле многих ядер, то образование МО из АО приводит к уменьшению энергии системы. Представим, что атом А, имеющий свободный или спаренный электрон, приближается к атому В. Из двух изолированных атомов образуется система, состоящая из двух ядер а и Ь, в поле которых находятся электроны этих атомов. Если молекула состоит из п атомов с суммарным числом электронов jV, то состояние молекулы можно представить системой из п силовых центров, в поле которых находится N электронов. Такое представление о молекуле как о взаимодействующем коллективе всех ядер и электронов лежит в основе теории метода МО. [41]
Страницы: 1 2 3