Энергия - активация - данная реакция
Cтраница 3
При этом возможна оценка энергии активации данной реакции без прямых каталитических опытов. [31]
Если значения констант скорости Ьт, и kTl для двух температур ( Т2 и 7) известны, то по уравнению можно найти значение Е для данной реакции, при помощи которого затем вычислить константу скорости этой реакции при любой температуре. Величина Е имеет размерность энергии и представляет собой энергию активации данной реакции. [32]
Если значения констант скорости & Т2 и йт, для двух температур ( Т2 и 7) известны, то по уравнению можно найти значение Е для данной реакции, при помощи которого затем вычислить константу скорости этой реакции при любой температуре. Величина Е имеет размерность энергии и представляет собой энергию активации данной реакции. [33]
Пример графического определения энергии активации дан на рис. 6, стр. Скорость реакции возрастает с увеличением температуры тем резче, чем больше энергия активации данной реакции. [34]
Из выражения ( 23) следует, что чем меньшие величины доступны измерению, тем меньшее количество катализатора можно определить в данном объеме. Из сопоставления уравнений ( 22) и ( 23) видно, что величина произведения & t - Nk ( следовательно, и чувствительность каталитической реакции) увеличится при возрастании периода наблюдения ( АО, концентрации реагирующих веществ ( Пс ] и каталитического коэффициента ( х), который, как известно [2], возрастает с увеличением температуры, и тем резче, чем больше энергия активации данной реакции. [35]
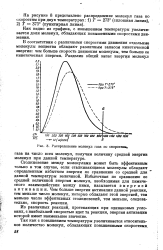 |
Распределение молекул газа по скоростям. [36] |
Столкновение между молекулами может быть эффективным только в том случае, если сталкивающиеся молекулы обладают определенным избытком энергии по сравнению со средней для данной температуры величиной. Избыточная по сравнению со средней величиной энергия молекул, необходимая для химического взаимодействия между ними, называется энергией активации. Чем больше энергия активации данной реакции, тем меньше число молекул, которые обладают этой энергией, тем меньше число эффективных столкновений, тем меньше, следовательно, скорость реакции. [37]
Повышением температуры можно увеличить число молекул, обладающих высокой энергией движения, и таким образом повысить скорость реакции между ними, но и этого иногда бывает недостаточно. Катализатор снижает энергию активации данной реакции. [38]
В окислительных процессах активны не только катализаторы основного типа. В многочисленных исследованиях была продемонстрирована возможность применения кислотного типа катализаторов в реакциях окисления различных веществ. Это близко к значениям энергии активации данной реакции на оксидах переходных металлов. [39]
Значения констант скоростей этой реакции определены при разных температурах сначала в отсутствие катализатора, а затем при добавлении иода. Энергия активации вычислялась с помощью уравнения Аррениуса и для каждого случая получено свое значение. Таким путем и обнаружено, что присутствие иода снижает энергию активации данной реакции. [40]
Примером применения постулата Хэммонда может служить решение вопроса о структуре комплекса, который моделирует переходное состояние, определяющее скорость реакции электро-фильного замещения в ароматических соединениях. Точка 2 на рис. 8 отвечает л - комплексу, а точка 4 - положительно заряженному - комплексу. Если подсчеты подтвердят, что энергия образования а-комплекса близка к энергии активации данной реакции, то в структурном отношении он должен иметь большое сходство с обоими переходными состояниями. [41]
Примером применения постулата Хэммонда может служить решение вопроса о структуре комплекса, который моделирует переходное состояние, определяющее скорость реакции электро-фильного замещения в ароматических соединениях. Точка 2 на рис. 8 отвечает я-комплексу, а точка 4 - положительно заряженному а-комплексу. Если подсчеты подтвердят, что энергия образования а-комплекса близка к энергии активации данной реакции, то в структурном отношении он должен иметь большое сходство с обоими переходными состояниями. [42]
Медленный ход химической реакции обычно можно приписать одному из двух факторов или им обоим. Во-первых, процессы разрыва и образования связей могут потребовать больше энергии, чем та, которой обладает большинство молекул реагирующей системы. Избыток энергии, который должны получить реагирующие молекулы, носит название энергии активации данной реакции. Хорошо известное ускорение реакций при повышении температуры обусловлено увеличением числа активированных молекул в рассматриваемой системе. [43]
Этот комплекс имеет сходство как с реагирующими веществами, так и с продуктами реакции; он может несколько больше походить на одну из этих пар, но в нем всегда есть нечто от природы обеих. Переходное состояние обладает самой большой энергией по сравнению t любой промежуточной стадией реакции; выделить комплекс из сферы реакции невозможно, так как он обладает большей энергией, чем реагенты и продукты реакции, и поэтому наименее устойчив. Энергия, необходимая для превращения реагентов в переходное состояние, представляет собой энергию активации данной реакции ( А. Изменение энергии системы в ходе реакции может быть представлено графически в виде кривой, показывающей постулированные уровни потенциальной энергии на различных стадиях перехода от реагентов к продуктам реакции. Как видно из графика ( рис. 4), энергия активации равна разности энергий начального и промежуточного состояний. Если энергия конечной системы меньше, чем у исходной ( рис. 4 а), то в ходе реакции энергия выделяется в виде тепла: такая реакция называется экзотермической, и теплота реакции ДЯ имеет отрицательный знак. Для протекания эндотермической реакции ( рис. 4 6) требуется дополнительная энергия; теплота такой реакции имеет положительный знак. [44]
В ряде случаев молекулы в газовой смеси не обладают необходимой энергией движения, чтобы при столкновении нреодо-леть силы, препятствующие их химическому взаимодействию. Повышением температуры можно увеличить число молекул, обладающих высокой энергией движения, и таким образом повысить скорость реакции между ними, но и этого иногда бывает недостаточно. Катализатор снижает энергию активации данной реакции. [45]
Страницы: 1 2 3 4