Энергия - активация - рекомбинация
Cтраница 3
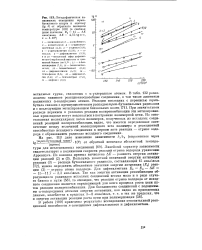 |
Логарифмическая зависимость отношения трет-бутилового спирта к ацетону ( lg А от обратного значения температуры ( в скобках даны значения Е2 15 - A. ккал / моль, А. Е 4 57 - tg ос-8, е 5 - 108. [31] |
Линейный характер зависимости свидетельствует о подчинении скорости реакций отрыва водорода уравнению Аррениуса. Так как энергия активации рекомбинации образующихся радикалов исходных соединений весьма мала и в ряде случаев близка к нулю [58], то очевидно, что реакция отрыва водорода от исходного соединения является определяющей для всего процесса роста цепи путем реакции полирекомбинации. [32]
Для этильных радикалов было отчетливо показано, что рекомбинация радикалов происходит по механизму голова к голове [284, 286], а диспропорционирование - по механизму голова к хвосту. Вследствие конфигурации голова к голове при рекомбинации радикалов может возникнуть взаимное отталкивание орбит С - Н связей при сближении радикалов, которое позволит перекрыться орбитам связывающихся электронов. Этот энергетический барьер должен быть того же порядка величины, что и барьер, препятствующий вращению вновь образующейся связи при рекомбинации радикалов, как это было принято для модели, описывающей реакцию рекомбинации. Наблюденная величина энергии активации рекомбинации приписывается целиком этому эффекту. [33]
Из всех стадий кинетической цепи наиболее трудной является стадия термического инициирования, имеющая энергию активации 118ккал / моль. Однако, если она определяется лишь прочностью С-С связи, то обрыв цепи контролируется диффузией радикалов в полимерной матрице и ограничивается ее вязкостью. Из этого следует, что кинетические характеристики этой стадии процесса деполимеризации зависят от физического состояния полимера, определяющегося подвижностью сегментов полимерной цепи. Установлено [19.124], что для аморфной фазы ( расплава) энергия активации рекомбинации составляет Ег ЗОккал / моль, а для кристаллической Ег 65 ккал / моль. Вместе с тем, деполимеризация кристаллической фазы происходит с большей скоростью, чем аморфной, и если процесс плавления не реализуется в силу указанных выше причин ( кратковременности процесса нагрева или влияния давления), то происходит двухскоростная деполимеризация ПТФЭ: разложение кристаллической фазы происходит быстрее, чем аморфной. Это может быть одной из причин диспергирования ПТФЭ при высокоинтенсивных процессах нагружения. [34]
Таким образом, энергия активации реакции рекомбинации перекис-ных радикалов составляет в кристаллической фазе 26 3 ккал / моль, а в аморфной фазе 11 3 ккал / моль. Для первичных ( алкильных) радикалов в разных углеводородных полимерах получены значения энергии активации рекомбинации, равные 20 - 40 ккал / моль. Для полиметилметакрилата методом ЯМР измерена величина потенциального барьера вращения сегментов полимерной цепи [24], которая оказалась равной 27 10 ккал / моль, а энергия активации рекомбинации радикалов составляла 28 ккал / моль. [35]
Часто эту информацию можно получить методом ИК-спектроско-пии. Например, с помощью последнего метода в продуктах газофазного импульсного фотолиза дифтордибромметана при записи спектра примерно через 1 мс после вспышки была обнаружена и идентифицирована частица Ср2, а в продуктах фотолиза трифториодметана обнаружен три-фторметильный радикал. Кинетическими измерениями методом ИК-спектроскопии было показано, что энергия активации рекомбинации двух радикалов CF3 отлична от нуля. [36]
Часто эту информацию можно получить методом ИК-спектроско-пии. Например, с помощью последнего метода в продуктах газофазного импульсного фотолиза дифторднбромметана при записи спектра примерно через 1 мс после вспышки была обнаружена и идентифицирована частица CF2, а в продуктах фотолиза трифториодметана обнаружен три-фтормстильный радикал. Кинетическими измерениями методом ИК-спсктроскопии было показано, что энергия активации рекомбинации двух радикалов CF3 отлична от нуля. [37]
Механизм обрыва экспериментально определяют путем оценки числа осколков инициатора на молекулу полимера. Для этого необходимо измерить молекулярный вес полимера и общее число осколков инициатора в нем. Хотя не для всех полимеров можно провести такие исследования, можно сказать, что обрыв большинства полимерных радикалов наступает в результате реакции рекомбинации. Исследования, выполненные на небольших алифатических радикалах, например этилыюм, изопропильном и ттгреиг-бутильном, показали, что реакция диспропорционирова-ния начинает играть большую роль в случае разветвленных радикалов при высоких температурах полимеризации. Реакция рекомбинации разветвленных радикалов стерически затруднена. Протеканию реакции диспропорционирования благоприятствует также увеличение количества ( З - водородных атомов, участвующих в реакции передачи цепи. Так, если при полимеризации стирола обрыв идет только в результате рекомбинации, то для полимеризации метилметакрилата характерен обрыв как путем рекомбинации, так и вследствие диспропорционирования. Степень диспропорционирования в последнем случае возрастает с температурой, потому что энергия активации диспропорционирования примерно на 5 ккал / моль ( 21 - 103 Дж / моль) больше энергии активации рекомбинации. [38]
Страницы: 1 2 3