Энтальпии - процесс
Cтраница 3
 |
Зависимость энтальпии перехода моля воды из водного раствора NaCI в чистую жидкую воду от температуры. [31] |
Сеченова резко возрастает с температурой. В работе [13] было показано, что при растворении газа в воде и высоких температурах изменение энтальпии процесса растворения происходит преимущественно в результате уменьшения энтальпии воды при добавлении к ней электролита. [32]
Отсюда видно, что полезная работа турбины может быть рассчитана как разность энтальпий торможения начала и конца процесса расширения. Другими словами, если в формуле ( 41) энтальпии торможения процесса будут взяты без трения, то получим располагаемую работу процесса расширения. Если же будут взяты такие же энтальпии процесса с трением, то будем иметь полезную работу процесса расширения с учетом внутренних потерь. [33]
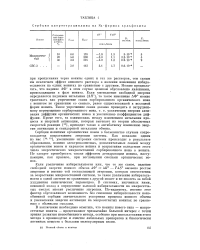 |
Сорбция хлортетрациклина на Na-формах сульфосмол. [34] |
Можно предполагать, что падение АФ в этом случае целиком обусловлено явлениями, происходящими в фазе ионита. Если уменьшение свободной энергии определяется падением энтальпии ( Д / /), то такое изменение АФ можно трактовать как упрочнение связи сорбированного органического иона с ионитом по сравнению со связью, ранее существовавшей в исходной форме ионита. Кроме того, та взаимосвязь между изменением энтальпии процесса и энергией активации, которая вытекает из теории абсолютных скоростей реакции [13], приводит также к антибатному изменению энергии активации и стандартной энтальпии обмена. [35]
Первоначальная кристаллизация всегда приводит к образованию низкоплавкой формы ( она обозначается как кристалл II; Ttp 153 88 К, ДЯт - - 3 021 ккал / молъ), которая после расплавления более чем наполовину и нагревания до точки плавления высокоплавкой формы ( обозначаемой как кристалл I; Ttp 154 29 К, ДЯт 2 964 ккал / молъ) превращается в более высокоплавкую модификацию и затем может перекристаллизоваться в высокоплавкую форму. Таким образом, энтальпия плавления кристалла I на 0 057 ккал / молъ меньше, чем кристалла II; эта величина соответствует изменению энтальпии процесса кристалл II - кристалл I при температуре плавления. [36]
Первоначальная кристаллизация всегда приводит к образованию низкоплавкой формы ( она обозначается как кристалл II; Ttp 153 88 К, ДЯт 3 021 ккал / молъ), которая после расплавления более чем наполовину и нагревания до точки плавления высокоплавкой формы ( обозначаемой как кристалл I; Ttp 154 29 К, ДЯт. Таким образом, энтальпия плавления кристалла I на 0 057 ккал / молъ меньше, чем кристалла II; эта величина соответствует изменению энтальпии процесса кристалл II - кристалл I при температуре плавления. [37]
Перенос электрона относится к наиболее фундаментальным явлениям физической химии, лежащим в основе большинства окислительно-восстановительных и кислотно-основных реакций, исследуемых в самых различных областях химии и биологии. Среди изучаемых моделей особое место принадлежит электродным реакциям, важной особенностью которых по сравнению с гомогенными реакциями переноса электронов в конденсированной фазе является линейная связь энтальпии процесса с потенциалом электрода, позволяющая плавно ее изменять при сохранении остальных условий протекания реакции. [38]
В последнее время благодаря использованию термодинамического метода достигнуты некоторые успехи в осуществлении рационального подбора катализаторов. Они показали, что в ряде случаев наиболее активны те катализаторы, у которых изменения энтальпии реакций образования и разложения промежуточных ( объемных) соединений одинаковы и равны половине изменения энтальпии суммарного катализируемого процесса. [39]
Углеводородная цепь такой же длины, как и в молекуле бутана, которую уже можно считать довольно гидрофобной группой, обладает свободной энергией переноса из жидкого бутана в воду 5 9 ккал / моль ( 24 7 - 103 Дж / моль) и энтропией переноса - 22 энтр. Дж / моль - К), что не очень сильно отличается от энтропии переноса метана. Противоположные по знаку величины А / / для метана и для инкремента на каждую метиленовую группу почти полностью взаимно компенсируются в случае бутана, и остается лишь небольшая величина - 0 8 ккал / моль ( - 3 35 - 103 Дж / моль), которая, возможно, отражает небольшое увеличение числа водородных связей вблизи молекулы углеводорода. Аналогичное исчезновение благоприятной энтальпии процесса наблюдается для ароматических молекул; энтальпия переноса молекул бензола из бензола в воду равна 0 6 ккал / моль ( 2 5 - 103 Дж / моль) при 25 С. Термодинамические параметры растворения длинных углеводородных цепей в воде исследовали на спиртах и неионных детергентах, которые обладают достаточной растворимостью, чтобы обеспечить сравнительную легкость экспериментальных измерений. Однако у соединений с короткой цепью наблюдается небольшое изменение или уменьшение А с ростом длины цепи ( до четырех атомов углерода), что указывает на влияние полярной группы на термодинамические параметры растворения углеводородной цепи. [40]
Как видно из рис. 3, отдельных сигналов молекулярного и ионного комплексов не наблюдается; полученная оценка нижней границы частоты протонной миграции дает значение т 1 106 сек 1 при-170 С. В табл. 1 приведены рассчитанные химические сдвиги О ETHNIC - протона в таутомерных комплексах различных карбоновых кислот с триметиламином в CHF2C1 и величины энтальпии внутри-комплексного перехода протона. Видно, что с усилением кислоты происходит смещение ОН-сигнала в слабое поле, одновременное смещение ГШ - сигнала в сильное поле ( что можно рассматривать как указание на ослабление водородной связи в ионной паре) и увеличение энтальпии процесса. Как видно из изложенного, ЯМР при низких температурах дает ценную информацию о тау-томерном равновесии ( 3, б), однако целесообразно применять этот. [41]
Любое фазовое превращение ( как аллотропическое, так и агрегатное) представляет собой изотермический процесс. В точках фазовых превращений имеет место скачкообразное изменение энтальпии реакции. Скачок определяется величиной энтальпии превращения. Энтальпии аллотропических превращений обычно невелики и, как правило, не превышают 1 ккал. Энтальпии процессов плавления ( или кристаллизации) достигают величины нескольких килокалорий, а энтальпии процессов кипения и возгонки - нескольких десятков килокалорий. [42]
Результаты температурных измерений изобразите графически. По уавнению реакции, зная навеску цинка и концентрацию раствора меди, определите, какое из веществ было взято в избытке. Эксг перимент желательно повторить дважды и воспользоваться средним значением энтальпии процесса. [43]
Любое фазовое превращение ( как аллотропическое, так и агрегатное) представляет собой изотермический процесс. В точках фазовых превращений имеет место скачкообразное изменение энтальпии реакции. Скачок определяется величиной энтальпии превращения. Энтальпии аллотропических превращений обычно невелики и, как правило, не превышают 1 ккал. Энтальпии процессов плавления ( или кристаллизации) достигают величины нескольких килокалорий, а энтальпии процессов кипения и возгонки - нескольких десятков килокалорий. [44]
 |
Параметры молекулярных комплексов ( м. к. и ионных пар ( и. п., образующихся между карбоновыми кислотами и триметиламином. [45] |
Страницы: 1 2 3 4