Энтальпий
Cтраница 3
Оно действительно и для энтальпий образования других подобных веществ, а также различных однотипных процессов, когда (11.23) неприменимо. [32]
Существующие методики расчета ДНП и энтальпий, как правило, рассчитаны на узкий диапазон изменения температур, давлений, класса углеводородов, В принципе эти методики описывают одно и то же явление / подчиняющееся одинаковым закономерностям, разными спрсог бами на азе статистических и корреляции экспериментальных данных. Некоторые из них базируются на теоретических соотношениях с определенными эмпирически поправочными коэффициентами, другие, включая и те, которые выведены из закона соответственных состояний, основаны на частично эмпирических обобщениях. Полностью эмпирические соотношения удобны и правомерны только для случаев, близких к тем условиям, для которых они были выведены. [33]
Так как отклонения расходов и энтальпий от среднего значения равновероятны, в большинстве случаев можно считать, что температура пара после смешения равна средней температуре по змеевикам. Совпадение это должно наблюдаться при числе замеров по змеевикам больше 10 и служит эффективным средством проверки правильности измерений. [34]
Существующие методики расчета ДНП и энтальпий, как правило, рассчитаны на узкий диапазон изменения температур, давлений, класса углеводородов. В принципе эти методики описывают одно и то же явление, подчиняющееся одинаковым закономерностям, разными способами на базе статистических и корреляции экспериментальных данных. Некоторые из них базируются на теоретических соотношениях с определенными эмпирически поправочными коэффициентами, другие, включая и те, которые выведены из закона соответственных состояний, основаны на частично эмпирических обобщениях. Полностью эмпирические соотношения удобны и правомерны только для случаев, близких к тем условиям, для которых они были выведены. [35]
Значения плотностей, объемов и энтальпий жидкости и пара являются первоначальными. Значения коэффициентов dildp и dp / dp в интервале температур от 0 до 30 С могут быть приняты постоянными. Они легко определяются из соответствующих таблиц и диаграмм. [36]
Значения плотностей, объемов и энтальпий жидкости и пара являются первоначальными. [37]
 |
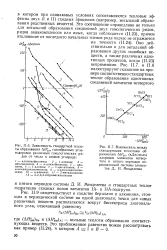
Графическое определение числа теоретических тарелок по энтальпийной диаграмме. [38] |
Пересечение рабочей линии Р-4 с кривой энтальпий паров в точке 5 определяет состав паров yNK, поднимающихся с верхней тарелки концентрационной части колонны. Точке 5 на кривой конденсации соответствует точка 6, ордината которой определяет температуру этих паров. Конода 6 - 7 дает точку 7, абсцисса которой определяет состав жидкости, стекающей с верхней тарелки. [39]
Абсолютные значения внутренних энергий и энтальпий индивидуальных веществ неизвестны, однако это не имеет значения, так как внутренние энергии и энтальпии можно отсчитывать от любого уровня, одинакового для исходных веществ и продуктов реакции. Тогда величины Я и U, характеризующие начало отсчета, будут исключены из окончательного результата, поскольку в левой и правой частях уравнения реакции находится одинаковое число атомов, из которых состоят реагирующие вещества. [40]
 |
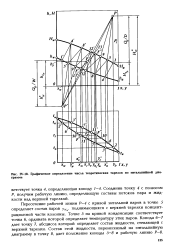
Схема расчета ДГЯ по. [41] |
Абсолютные значения внутренних энергий и энтальпий индивидуальных веществ неизвестны, однако это не имеет значения, так как внутренние энергии и энтальпии можно отсчитывать от любого уровня, одинакового для исходных веществ и продуктов реакции. Тогда величины Н и U, характеризующие начало отсчета, будут исключены из окончательного результата, поскольку в левой и правой частях уравнения реакции находится одинаковое число атомов, из которых состоят реагирующие вещества. [42]
В органической химии часто вместо энтальпий образования веществ применяются легко определяемые экспериментально энтальпии сгорания. [43]
В современных термохимических справочниках для энтальпий образования ионов в водном растворе приводятся значения, вычисленные исходя из условно принятой за нуль теплоты образования протона в растворе. [44]
На рисунке энтальпии растворов ограничены кривой энтальпий насыщенных растворов. Она проведена таким образом, что ее точка встречи с осью энтальпий безводного КОН соответствует энтальпии расплава едкого кали при температуре плавления. [45]
Страницы: 1 2 3 4