Равновесный выход
Cтраница 2
 |
Зависимость Ката ли з а т о р ы, используемые при оки. [16] |
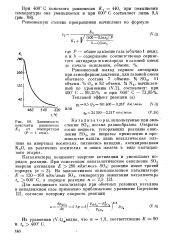
Равновесный выход серного ангидрида при атмосферном давлении, для газовой смеси обычного состава 7 объемн. [17]
Рассчитать равновесный выход в реакции С2Н4 Н2 С2Нб при Р1 ОЫ05 н / 2 ( 1 атм), Т 673 2 К и время, за которое может быть достигнут выход СгНе, равный 90 % от равновесного. [18]
Рассчитать равновесный выход в реакции С2Н4 Н2С2Нб при Р1 ОЫ05 н / м2 ( 1 атм), 7 673 2 К и время, за которое может быть достигнут выход С2Н6, равный 90 % от равновесного. [19]
Рассчитайте равновесный выход в реакции С2Н4 Н2 С2Нв при 1 01 105 Па, 673 2 К и время, за которое может быть достигнут выход С2Н, равный 90 % от равновесного. [20]
Вычисление равновесного выхода производят по формулам типа ( 6) и ( 7), используя константы равновесия / Ср, приведенные в соответствующих справочниках. [21]
Расчет равновесных выходов этанола при гидратации этилена при давлениях ( 1, 20, 30, 50 и 100) 105 Па проводится с учетом отклонений свойств газовой смеси от идеальных свойств. [22]
Расчет равновесных выходов серы в зависимости от различных факторов, изменяющихся в условиях производства, позволяет установить оптимальный состав исходного газа, к получению которого и следует стремиться в производственной деятельности. Поэтому расчеты равновесных выходов серы имеют практическую ценность. [23]
Расчет равновесных выходов этанола при гидратации этилена при давлениях ( 1, 20, 30, 50 и 100) 105 Па проводится с учетом отклонений свойств газовой смеси от идеальных свойств. [24]
Зависимость равновесного выхода аммиака от тем - 1QQ пературы и давления. [25]
Хр - равновесный выход целевого продукта в молях в единице объема или других единицах; Тр - температура в К, при которой достигнуто равновесие; / С - константа равновесия при Тр К. [26]
Для определения равновесного выхода необходимо знать константу равновесия реакции. [27]
Примером повышения равновесного выхода хр с ростом температуры Т является эндотермическая реакция прямого синтеза окиси азота из элементов ( см. гл. [28]
Результаты расчета равновесного выхода реакции разложения силана при различных температурах приведены на рис. 7, из которого следует, что заданную величину равновесного выхода можно поддерживать ( при Mconst 0 003), изменяя состав газовой смеси и тмп - ратуру. [29]
Для обратимых процессов равновесный выход, совпадающий с равновесной степенью превращения, всегда меньше единицы ( хр 1), так как равновесие наступает при не полном превращении исходных веществ в продукт. [30]
Страницы: 1 2 3 4