Равновесный выход
Cтраница 3
Влияние температуры на равновесный выход, так же как и на величину константы равновесия, определяется знаком теплового эффекта реакции. [31]
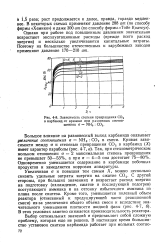 |
Зависимость степени превращения СОг в карбамид от времени при различных соотношениях о NH3. СО2. [32] |
Большое влияние на равновесный выход карбамида оказывает увеличение соотношения а NH3: CO2 в смеси. Одновременно уменьшается содержание в карбамиде побочных продуктов и замедляется коррозия аппаратуры. [33]
При этой температуре равновесный выход серы достигает 90 %, но практически он несколько ниже и составляет 80 - 85 % в зависимости от объемной скорости и активности катализатора. [34]
Нужно ли добиваться равновесного выхода карбамида на установках с замкнутым циклом. [35]
Предложена функциональная зависимость равновесного выхода восстановителей при пароуглеводородной конверсии от изменения термодинамического потенциала сгорания углеводородов. [36]
Характер влияния давления на равновесный выход в соответствии с уравнением ( XIV, 13) определяется знаком разности числа молей газообразных реагентов Дл и зависимостью К, от давления. [37]
 |
Термодинамические параметры реакций гидрохлорирования хлорэтенов в жидкой фазе. [38] |
Следует отметить, что равновесный выход 1 1-дихлорэтана значительно выше равновесного выхода трихлорэтанов в сопоставимых условиях из-за большего теплового эффекта реакции. Тепловой эффект реакций гидрохлорирования хлоралкенов заметно снижается по мере увеличения атомов хлора в молекуле непредельного соединения. Вследствие этого проведение процессов гидрохлорирования 1 1-дихлорэтена и смлш-дихлорэтенов в газовой фазе при температурах, обеспечивающих высокие скорости протекания реакций ( 100 - 150 С), затруднено из-за малых степеней превращения. Для увеличения конверсии непредельных соединений следует применять повышенное давление, что может оказаться затруднительным с точки зрения аппаратурного оформления процесса. [39]
Характер влияния давления на равновесный выход в соответствии с ( XIV, 13) определяется знаком разности числа молей газообразных реагентов Д и зависимостью / CY от давления. [40]
Как показывают расчеты, равновесный выход SO3 возрастает с понижением температуры, поскольку реакция ( 1) экзотермична при низких температурах. [41]
На основе термодинамического расчета равновесных выходов d - метилстирола и сочетания их с экономическими показателями процесса можно оценить оптимальное отношение водяного пара к изопропилбензолу, которое необходимо поддерживать в реакторе. [42]
Таким образом, предсказание равновесных выходов в реальных растворах в общем случае практически невозможно. [43]
На основе термодинамического расчета равновесных выходов d - метилстирола и сочетания их с экономическими показателями процесса можно оценить оптимальное отношение водяного пара к изопропилбензолу, которое необходимо поддерживать в реакторе. [44]
На основе термодинамического расчета равновесных выходов d - метил стирол а и сочетания их с экономическими показателями процесса можно оценить оптимальное отношение водяного пара к изопропилбензолу, которое необходимо поддерживать в реакторе. [45]
Страницы: 1 2 3 4