Вычисление - константа - равновесие
Cтраница 3
В общем случае при вычислении констант равновесия гетерогенных реакций необходимо учитывать только парциальные давления газообразных веществ, взяв их в степени, равной стехиометрическому коэффициенту, стоящему перед данным веществом в уравнении химической реакции. [31]
Главным источником ошибок при вычислении константы равновесия диссоциации молекулярного фтора [24, 25, 26] служит неточность определения величины энергии его диссоциации. [32]
Для рассмотренных реакций возможно также вычисление констант равновесия кинетическим методом. [33]
Естественно, что его попытки вычисления константы равновесия образования этого несуществующего в действительности вещества не привели к удовлетворительным результатам и поэтому здесь не приводятся. [34]
 |
Константа нестойкости комплексных нонов, образование которых вероятно в щелочных цианистых растворах. [35] |
В табл. 35 показаны результаты вычисления констант равновесия реакций минералов со щелочью при отсутствии кислорода и цианида. Протекание их представляется невозможным и образование Na2S или Na2S2 этим путем практически исключено. [36]
Отсюда следует, что при вычислении константы равновесия реакции множители, учитывающие ядерный спин, могут быть опущены в выражении для суммы состояний. Разумеется, порядок симметрии всегда сохраняется в выражении. [37]
Такое несоответствие находится вне пределов ошибки вычисления константы равновесия и, по-видимому, не связано с ошибками измерений скорости. [38]
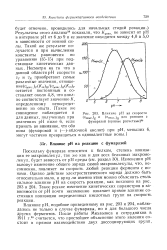 |
Влияние рН на скорости ( макс. /. ДЛЯ Реак ии с. [39] |
Такой же результат по-лучается и при вычислении константы равновесия по уравнению ( 35 - 15) при подстановке кинетических данных. [40]
Главное применение стандартных таблиц заключается в вычислении констант равновесия. [41]
Третья область применения термодинамики в химии связана с вычислением константы равновесия обратимого химического превращения при различных температурах на основании данных о значении этой константы при какой-либо одной температуре. [42]
Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. [43]
В заключение этого раздела можно добавить, что при вычислениях констант равновесия и термодинамических функций для этих целей спиновый множитель яд в (5.101) и (5.102), (5.103) и (5.104) можно опустить, так как состояние ядер в отсутствие орто-пара-превращений при химической реакции не изменяется. [44]
Таким образом, одна из важнейших задач теоретической химии - вычисление констант равновесий любой реакции при любых условиях - полностью решена на основе только термических свойств веществ, а именно стандартных энтальпий образования, стандартных энтропии и температурных зависимостей теплоемкостей. [45]
Страницы: 1 2 3 4