Константа - скорость - стадия
Cтраница 4
РЗ и Р4 - парциальные давления соответственно спирта, кето на, водорода и постороннего вещества), которое при различных соотношениях констант скоростей стадий дает разные предельные случаи. [46]
На основе этих условий был разработан алгоритм, использующий только сте-хиометрическую матрицу стадийной схемы реакции и оценивающий снизу число ВСС в предположении, что константы скоростей стадий могут принимать любые положительные значения. Затем последовательно добавляются стадии рассматриваемого механизма, не входящие в исходную совокупность стадий, отслеживается появление новых ГСС и направление движения в симплексе реакции, найденных на предыдущем этапе ГСС. При движении ГСС возможны следующие случаи. [47]
В разделах 4.1 и 4.2 мы видели, что различные макрокинетические области протекания реакции реализуются тогда, когда константы скорости соответствующих стадий существенно меньше константы скорости стадии химической реакции. [48]
Однако она может представлять собой более сложное выражение, чем величина, входящая в уравнение закона действующих масс, вследствие возможной зависимости ее от величин констант скоростей стадий. Если скорость многостадийного процесса выражается сложной зависимостью от концентраций ( а не степенной зависимостью), то в аргумент функции f в уравнении (1.12) может входить несколько постоянных. [49]
В других случаях уравнения содержат в знаменателе только один член или, при наличии нескольких слагаемых, постоянные в знаменателе могут оказаться более сложными выражениями, содержащими также величины констант скоростей стадий и их отношения. Так, например, в работе А. А. Баландина и автора [488] были рассмотрены постоянные в кинетическом уравнении дегидрирования спиртов на квазиоднородной поверхности катализатора. [50]
Приведенные выше данные показывают, что при определении кинетических характеристик стадии 1 2-сдвига заместителей в оксибензолониевых ионах необходимо работать в достаточно сильнокислых средах, когда влияние сольватационных факторов становится незначительным и константа скорости стадии 1 2-сдвига не зависит более от кислотности среды. Пока лишь в двух работах проведены измерения, удовлетворяющие этому требованию. [51]
Как видно из предыдущих глав, величины констант скорости, входящие в кинетические уравнения, могут характеризовать скорость отдельных стадий шли представляют собой сложные выражения, содержащие произведения, отношения или суммы констант скоростей стадий. [52]
Бели сделать разумные оценки констант равновесия стадий ( II) и ( IV), то, как впервые отметил Эйген [165], из величин наблюдаемых скоростей некоторых каталитических процессов следует, что константы скорости стадий ( I) и ( III) должны были бы иметь большие значения, чем соответствующие величины у диффузионно-контролируемых реакций. Иными словами, время, необходимое для того, чтобы частицы А и В стали свободными и двигались по направлению к атому кислорода гидрата, могло бы оказаться недостаточным. Исходя из этого, Эйген [165] предположил, что суммарный процесс ( I) ( II) или ( III) ( IV) осуществляется в одном акте. В этом случае говорят, что реакция протекает через образование контактного, или интимного комплекса. [53]
В достаточно сложных процессах, содержащих стадии второго и более высоких порядков, системе (V.149) может удовлетворять несколько наборов величин [ Х ] ст. Это означает, что при заданных значениях Дп, и, V и констант скорости стадий может существовать несколько различных стационарных режимов. Реализуется тот или иной режим в зависимости от начальных концентраций компонентов в реакторе. Каждому стационарному режиму соответствует область начальных концентраций, исходя из которой этот стационарный режим может быть достигнут. [54]
Во всех других случаях в знаменатель уравнения входит величина концентрации или парциального давления только одного вещества, причем постоянные входят в общую константу, или же, если при нескольких слагаемых, постоянные содержат величины констант равновесия или констант скоростей стадий, а не только адсорбционные коэффициенты. [55]
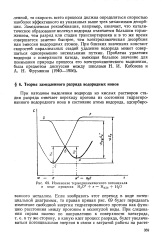 |
Изменение термодинамического потенциала в ходе процесса Н3О е Надо Н2О. [56] |
Замедленная рекомбинация, например, означает, что каталитическое образование молекул водорода отличается большим торможением, чем разряд или стадия транспортировки и в то же время совершается заметно быстрее, чем электрохимическая десорбция или эмиссия водородных атомов. При близких значениях констант скоростей параллельных стадий удаление водорода может совершаться одновременно несколькими путями. [57]
Страницы: 1 2 3 4