Кривая - равновесие
Cтраница 2
Кривая равновесия получается при приравнивании химических потенциалов компонентов двух фаз, находящихся в равновесии. Здесь химический потенциал определяется как производная свободной энергии по объему компонента в соответствующей фазе. Обычное выражение концентрации в молях или мольных долях здесь заменено на объемные доли. Очевидно, что это предполагает аддитивность объемов. [16]
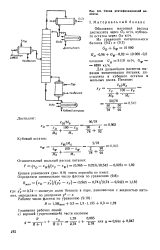 |
Схема ректификационной колонны. [17] |
Кривая равновесия ( рис. 9.9) точек перегиба не имеет. [18]
 |
Показатели работы ступенчато-противоточного аппарата.| Схема ступенчато-противоточного аппарата. [19] |
Кривая равновесия а / ( а) сильно изогнута в сторону оси абсцисс. [20]
Кривая равновесия задана уравнением С КХ, где X - концевтрация абсорбируемой примеси s абсорбенте, К - констар - а равновесия. [21]
Кривая равновесия задана уравнением С КХ. [22]
Кривая равновесия для бинарной смеси ( рис. 5 - 2 в) иллюстрирует зависимость состава пара от состава жидкой смеси. Состав смеси обычно характеризуется содержанием в ней летучего компонента, поэтому по оси абсцисс откладывается содержание летучего компонента в жидкости х, а по оси ординат - в парах у. Величины х и у обычно выражаются или в моль-процентах, или в весовых процентах. [23]
Кривая равновесия может быть построена по кривым кипения и конденсации, если по оси абсцисс откладывать абсциссы кривой кипения, а по оси ординат - соответствующие той же температуре абсциссы кривой конденсации. [24]
Кривая равновесия между жидким и твердым Не3 была изучена в Аргоннской лаборатории [62] до температуры 0 16 К. [25]
Кривая равновесия характеризует связь между концентрацией жидкости XB и соответствующей концентрацией пара у в состоянии равновесия. Кривая равновесия является, следовательно, основой для расчета числа теоретических тарелок графическим методом Мак-Кэба и Тиле [63], который благодаря своей простоте наиболее часто применяется на практике. В табл. П / 4, ряд III ( приложение) приведены кривые равновесия для смесей различного типа. В случае нерастворимых веществ кривая равновесия представляет собой прямую линию ( тип 1), пересекающую диагональ в точке, которая называется особой точкой. В этой точке концентрация паров равна концентрации жидкости; обогащение паров нижекипящим компонентом при более высокой концентрации жидкости хв уже невозможно; наоборот, пары в этой области концентраций жидкости содержат меньше нижекипящего компонента, чем жидкость. Для смесей типа 4 характерна форма кривой, свойственная идеальным смесям, в которых у всегда больше хв. [26]
Кривая равновесия изображена на фиг. [27]
Кривая равновесия делит поле диаграммы на две части. Влево и вверх ( к большим температурам и меньшим давлениям) расположена область устойчивого состояния пара. [28]
Кривая равновесия для растворов, подчиняющихся закону Рауля, может быть построена ( см. стр. [29]
Кривая равновесия и диагональ ограничивают область взаимного существования двух фаз. Выше кривой равновесия расположена область пара, а ниже-область жидкости. [30]
Страницы: 1 2 3 4