Потенциометрическая кривая
Cтраница 2
Нерегулярность потенциометрических кривых, вызванная ассоциацией. В инертных растворителях, например толуоле, кислоты и фенолы ассоциированы за счет образования водородных связей. [16]
Форма нерегулярных потенциометрических кривых может быть самой различной. [17]
Строят потенциометрическую кривую в координатах потенциал - объем и по третьему скачку потенциала рассчитывают содержание тринитротолуола. Проводят холостой опыт, результат которого учитывают при расчетах. [18]
Были получены удовлетворительные потенциометрические кривые при титровании около 2 мг Pu ( III) до Pu ( IV) 0 01 jV раствором К2Сг2О7 в 3N HgSO. Дальнейшее окисление Pu ( IV) идет очень медленно. [19]
Общий характер потенциометрических кривых, заснятых с помощью электродных пар с различными индикаторными электродами, показан на рис. XI.15. При изменении исходных концентраций цианидов потенциомет-рические кривые лишь сдвигаются по отношению друг к другу, не изменяя общего характера. [20]
Если на потенциометрической кривой в этилендиамине обнаруживается два перегиба, то при расчетах в качестве эквивалентного объема принимают разность между первой и второй точками перегиба. В случае только одного перегиба большое количество очень слабой кислоты может затемнять конечную точку титрования небольшого количества сильной кислоты. Перегиб на кривой, полученный таким образом, соответствует кривой потенциометрического титрования очень слабой кислоты только в том случае, когда две кривые или конечные точки титрования сравнимы с данными, полученными в модельном опыте с фенолом. Для вычисления результатов титрования слабых кислот используют разность объемов титранта при титровании образца и в глухом опыте. [21]
Как видно, потенциометрическая кривая двухступенчата, что также свидетельствует о наличии в растворе двух форм с различными значениями окислительно-восстановительных потенциалов. [22]
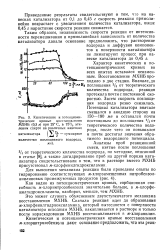 |
Кинетические и потенциоме-трические кривые восстановления МХНБ ( 0 3 г при 25 С, в 75 % этиловом спирте на различных навесках. [23] |
Как видно из потенциометрических кривых, сорбционная способность ж-хлорнитрозобензола значительно больше, а ж-хлорфе-нилгидроксиламина, наоборот, меньше, чем МХНБ. [24]
В каких случаях титрования потенциометрическая кривая спадает, а в каках случаях возрастает. [25]
В каких случаях титрования потенциометрическая кривая спадает, а в каких случаях возрастает. [26]
В каких случаях титрования потенциометрическая кривая спадает, а в каках случаях возрастает. [27]
Точка эквивалентности лежит на потенциометрической кривой и определяется половиной ее высоты. [28]
Точку эквивалентности находят по потенциометрической кривой. [29]
Конечную точку титрования находят по потенциометрическим кривым титрования. [30]
Страницы: 1 2 3 4