Кинетическая кривая - накопление
Cтраница 3
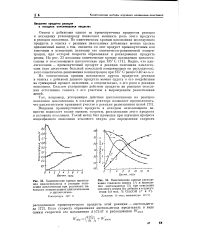
Изменение д; и у во времени показано на рис. 86, где они сопоставлены с кинетическими кривыми накопления трехвалентного кобальта и циклогексанона в реакции окисления циклогек-сана. Хорошее сходство между расчетными и опытными данными еще раз подтверждает правильность представлений об ингибирующей способности двухвалентного кобальта в начале реакции окисления. Максимум на экспериментальной кинетической кривой накопления трехвалентного кобальта связан с появлением альдегидов, восстанавливающих его в двухвалентное состояние. Появление в реакции гидроперекиси превращает и двухвалентный кобальт из ингибитора в инициатор цепей. На ингибирующее действие двухвалентного кобальта и марганца указывает также ряд фактов, которые до настоящего времени не получили правильного объяснения. Окончание периода индукции совпадает с моментом быстрого перехода кобальта из двухвалентного в трехвалентное состояние. Добавка гидроперекиси уничтожает период индукции. [31]
В простейшем случае признаками последовательного характера реакции служат: различие скоростей расходования реагентов и образования продуктов и так называемый S-образный характер кинетической кривой накопления продуктов. [32]
При; этом оказалось, что кинетическая кривая накопления моноокиси серы, снятая по изменению интенсивности полос ио-глощения моноокиси серы в ходе окисления, совпадает с кинетической кривой накопления активного промежуточного продукта реакции, полученной кинетическим методом. Из этих данных следовало, что промежуточным продуктом, обусловливающим автокаталитический характер процесса окисления сероводорода, является моноокись серы. [33]
На основании общей схемы окисления углеводородов можно предполагать, что циклогексанол образуется только путем распада гидроперекиси циклогексила, поэтому максимум со концентрации должен совпадать с максимумом скорости па кинетической кривой накопления циклогексанола. Этого, однако, но наблюдается, что говорит или о наличии иных путей образования циклогексанола, или о некотором увеличении скорости распада гидроперекиси циклогексила но мере протекания реакции. [34]
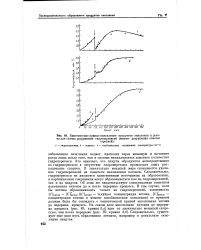 |
Кинетические кривые накопления продуктов окисления н. декана для случая разрушения гидроперекисей ( момент разрушения отмечен. [35] |
СЧкетон - [ Сметой ( [ СЧкетон - текущая концентрация кетона, [ Сметой - концентрация кетона в момент возобновления окисления) от времени должна была бы совпадать с кинетической кривой накопления кетона до перерыва процесса. Следовательно, существует еще один путь образования кетонов, например в результате окисления спиртов. [36]
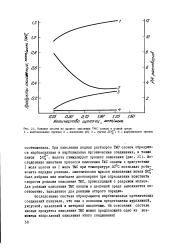 |
Влияние щелочи на процесс окисления ТМС озоном в водной среде. [37] |
Кинетическая кривая накопления ионов 0 - была избрана как наиболее достоверная при определении константы скорости реакции окисления ТМС, происходящей с разрывом кольца. Для реакции окисления ТМС озоном в щелочной среде выполняется соотношение, выведенное для реакции второго порядка. [38]
Неожиданным фактом явился довольно высокий выход углекислого газа ( табл. 1), причем количество его несравненно больше ожидаемого в результате отщепления углерода метиль-ной группы, что дает возможность предполагать расщепление нафталинового кольца. Кинетическая кривая накопления СОа имеет S-образный вид ( рис. 1), присущий продуктам последовательной реакции. [39]
Промежуточным продуктом окисления диэтилбензола в диацетилбен-зол является этилацетофенон. Кинетическая кривая накопления ацетофе-нона проходит через максимум. [40]
Опыты с добавками одного из промежуточных продуктов реакции к исходному углеводороду позволяют выяснить роль этого продукта в реакции окисления. По кинетическим кривым накопления исследуемого продукта в опытах с разными начальными добавками можно сделать однозначный вывод о том, является ли этот продукт промежуточным или конечным и установить величину его кинетически-равновесной концентрации, при которой скорости образования и расходования продукта равны. [42]
 |
Изменение температуры в зоне реакции. [43] |
Существует довольно значительное расхождение в скоростях образования и расходования ацетальдегида при медленном окислении и окислении в холодном пламени. При медленном окислении кинетическая кривая накопления ацетальдегида имеет S-образную форму, а при холодно-пламенном окислении - это кривая с минимумом. При сопоставлении удельных активностей, напротив, обнаруживается сходство между двумя процессами, так как в обоих случаях ацетальдегид одновременно и образуется и расходуется. [44]
В настоящее время используются в основном два типа установок импульсного фотолиза - кинетическая и спектрографическая, которые различаются способом регистрации. Кинетическая установка позволяет получать непосредственно кинетическую кривую накопления и гибели промежуточного продукта на любой длине волны регистрации. При помощи спектрографической установки регистрируется весь спектр промежуточных продуктов через определенный промежуток времени после фотолитической вспышки. Кроме наиболее распространенных спектральных методов регистрации используются также другие, например при образовании короткоживущих ионов измеряется кинетика электропроводности. [45]
Страницы: 1 2 3 4