Анодная кривая
Cтраница 3
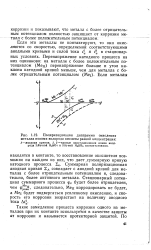
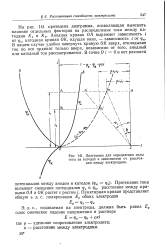 |
Диаграмма для определения силы тока на катодах в зависимости от расстояния между электродами. [31] |
Анодная кривая ОА выражает зависимость i от фа, катодная кривая ОД, идущая вниз, - зависимость i от фк. В нашем случае удобно повернуть кривую О / С вверх, откладывая ток по оси ординат только вверх, независимо от того, анодный или катодный ток рассматривается. [32]
Анодная кривая & Ей Р имеет характерную петлю перехода в пассивное состояние. Скорость коррозии при этом мала, однако в присутствии активных ионов значительно повышается. [33]
Анодная кривая & EaiP имеет характерную - петлю перехода в пассивное состояние. Отношение f EM / Eatl, что свидетельствует о превалирующем анодном контроле и характеризует заметную пассивность. Скорость коррозии при этом мала, однако в присутствии активных ионов значительно повышается. [34]
Анодные кривые титана в щели и объеме раствора свидетель-ствуют о значительно более высокой склонности титана к щелевой коррозии по сравнению с коррозией в объеме раствора. Общий вид анодной кривой титана в объеме раствора типичен для анодного поведения легкопассивирующихся металлов в растворах хлоридов и характеризуется потенциалом питтингообразования, равным 1 15 В. Однако по кривым изменения тока во времени видно, что уже при потенциале 0 7 В появляются всплески тока, свидетельствующие о зарождении дефектов в пленке, которые в условиях анодной поляризации могут залечиваться вплоть до потенциала пробоя. [35]
Анодная кривая сплава Ti - 0 2 % Pd в условиях щели при 160 С характеризуется очень широкой областью пассивного состояния, а потенциал начала развития щелевой коррозии сдвинут в положительную сторону по сравнению с критическим потенциалом для Ti в щели на 1 35 В. В то же время анодные кривые Ti и сплава Ti - 0 2 % Pd в объеме раствора отличаются незначительно как по величине тока, так и по значениям критических потенциалов, хотя критический потенциал Ti - 0 2 % Pd все же тюложительнее. Эти результаты свидетельствуют о том, что меха-шизм защитного действия легированного титана сводится к накоплению палладия в условиях ограниченного объема раствора в щели и к снижению перенапряжения катодного выделения водорода. [36]
 |
Поляризационная диаграмма окисления металла ионами водорода кислоты разной концентрации. [37] |
Суммарная поляризационная анодная кривая 1А совпадает с анодной кривой для металла с более отрицательным потенциалом и, следовательно, более активного металла. [38]
Суммарная поляризационная анодная кривая ЕА совпадает с анодной кривой для металла с более отрицательным потенциалом и, следовательно, более активного металла. [40]
Пусть анодная кривая - кривая Е аВ, а катодная - Е С. Точка пересечения этих кривых О указывает нам силу коррозионного тока 1кор и стационарный потенциал Ех, который устанавливается на обоих электродах рассматриваемой системы. Если вся система будет запо-ляризована до более отрицательного потенциала, например до EI, то сила тока на аноде уменьшится до значения / ь Анодный ток ( ток коррозии) в нашем элементе полностью прекратится, если система будет заполяризована до потенциала Е а. Поэтому сила поляризующего тока, как правило, должна быть больше достигаемого защитного эффекта. Сила защитного тока должна быть тем больше, чем больше катодная поверхность и чем меньше поляризуемость катода. Это значит, что при малой поляризуемости катода требуется очень большая сила тока. [41]
Если анодная кривая снимается гальваностатическим методом, то участок CPOQ не удается обнаружить. [42]
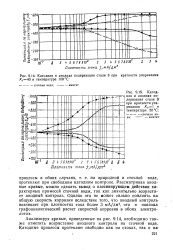 |
Катодная и анодная поляризация стали 3 при кратности упаривания Лу40 и температуре 100 С.| Катодная и анодная поляризация стали 3 при кратности упаривания Ку1 И температуре 20 С. [43] |
Рассматривая анодные кривые, можно сделать вывод о пассивирующем действии характерных примесей сточной воды, так как значительно возрастает анодный контроль. [44]
Характер анодных кривых для каждой структурной составляющей и каждого физически неоднородного участка зависит от химического состава этих составляющих, кристаллической структуры, концентрации ионов водорода, температуры, природы и концентрации активаторов, природы и концентрации анодных замедлителей, внутренних напряжений и приложенных внешних напряжений. [45]
Страницы: 1 2 3 4 5