Потенциодинамическая кривая
Cтраница 3
Адсорбционную способность Pt-Ti скелетных катализаторов по отношению к водороду в растворе 0 1 N H2S04 оценивали, с одной стороны, количеством электричества по кривой заряжения, затрачиваемым на снятие водорода с поверхности электродов и, с другой - площадью под анодной ветвью потенциодинамической кривой в водородной области. Величины адсорбционной способности Pt-Ti - электро-дов-катализаторов, рассчитанные гальваностатическим и потенциоди-намическим методами, хорошо совпадают. [31]
Растворение железа сопровождается прохождением катодного тока, который характеризует неполное восстановление хромат-ионов. На потенциодинамических кривых / - 1 это выражается в появлении дополнительной волны в области потенциалов растворения железа, которая предшествует обычной первой ветви восстановления хромовой кислоты, будучи смещенной на 0 2 В в положительную область. Высота этой волны меняется от состава раствора и температуры так же, как скорость растворения железа, поэтому она может служить относительной характеристикой скорости растворения железа, как более быстрый способ оценки вместо гравиметрического. Дополнительная волна исчезает при малой скорости растворения железа, как в отсутствии растворения. [32]
В связи с тем, что концентрация слабосвязанного водорода в щелочных растворах весьма велика, рассчитанные теплоты адсорбции водорода в щелочи ниже, чем в кислоте. Наличие нескольких максимумов на потенциодинамических кривых, а также перегибы на кривых зависимости теплоты адсорбции от степени заполнения свидетельствуют о большой неоднородности водорода, адсорбированного на платине как в кислой, так и в щелочной средах. [33]
Для измерения адсорбции водорода снимали катодные потенциодинамические кривые ток - потенциал ( /, ф-кривые) в интервале потенциалов фг 0 4 - 0 0 в [12] и, интегрируя их, находили площадь под /, ф-кривыми для неплатинированного и платинированного образцов. Разница этих площадей пропорциональна количеству адсорбированного водорода. [35]
 |
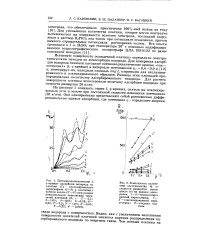
Анодные потенциодинамические кривые для сталей 1Х18Н10Т, Х17Н13М2Т, Х23Н28М2Т и титана ВТ1 - 1 в растворе, содержащем 20 % ВаС12 при различных температурах. а 60 С. б 98 С. в 102 С. [36] |
Для титана характерно наличие значительной области пассивного состояния. Повышение температуры не меняет основной вертикальный ход потенциодинамической кривой. Таким образом, из полученных кривых видно, что устойчивым материалом в приведенных условиях является титан. Он обладает высокой стабильностью пассивного состояния, не активируется ионами хлора в широкой области потенциалов в отличие от нержавеющих сталей. [37]
После подготовки образца его помещают в ячейку и катодно поляризуют при Е - 0 55 В в течение одной минуты, затем выдерживают три минуты при Е - - 0 2 В. После этого устанавливают потенциал Е 0 55 В и записывают потенциодинамическую кривую от Е 0 55 В до Е - 0 25 В. [38]
Кривые, характеризующие тнтаь, отличаются значительной областью пассивного состояния, с незначительным участком активного растворения при малых плотностях тока. Причем изменение концентрации раствора, а также повышение температуры не меняет основного вертикаль -, ного хода потенциодинамической кривой. Приведенные кривые свидетельствуют о стойкости титана в растворах хлористого магния, обусловленной наличием овисной пленки, отличающейся высокой прочностью. Что же касается нержавеющей стали ПШЮТ, то, как видно из кривых, область пассивного состояния при температуре 23 С характеризуется небольшим участком у - 0 15 - ( 0 05) в для всех исследуемых нами растворов. Стационарный потенциал при температуре 23 С находится в области пассивного состояния металла. [39]
По заданным значениям Эн рассчитывают Ег по уравнению ( 3.1 13) и строят i, Er - кривую. Аналогичные операции выполняют для каждого из максимумов водородной области и, суммируя рассчитанные кривые, описывают водородный участок потенциодинамической кривой. [40]
После анодно-катодной обработки электродов и многократного промывания их бидистиллятом на каждом электроде предварительно снимали обычные кривые заряжения и потенциодинамические /, ср-кривые с линейной разверткой потенциала 10 мв / мин. Pt и Ru изучали с помощью стационарных поляризационных кривых, кривых гидрирования нитрометана в адсорбционном слое водорода, потенциодинамических кривых с линейной разверткой потенциала 10 мв / мин и, наконец, кривых смещения потенциала в разомкнутой цепи или потенциостати-ческих кривых при непосредственном взаимодействии органического вещества с электродом, стабилизированным при 450 мв. [41]
Потенциодинамические кривые являются производными от кривых заряжения, с их помощью иногда удается более детально исследовать границу электрод - раствор. Но основное преимущество перед кривыми заряжения состоит в том, что периодическое окисление и восстановление электрода стабилизирует состояние его поверхности, уменьшается влияние загрязнений, поэтому Потенциодинамические кривые лучше воспроизводятся. [42]
Проведены сравнительные электрохимические исследования сталей КО-З и XI8HI0T в 15 -ной азотной кислоте с добавлением 500 и 2000 мг / л хлор-ионов при температуре 50 С. Исследовано влияние концентрации кислоты от 3 до 30 на электрохимические характеристики сталей. Потенциодинамические кривые получены при скорости развертки 0 4 мВ / С. [43]
Обращает на себя внимание, однако, одна интересная особенность. Оказывается, что с помощью достаточных концентраций нитрита натрия можно запассивировать сталь и в кислых электролитах, в которых стабильность фазовых пленок низка. На рис. 2 3 представлен ряд потенциодинамических кривых, полученных в кислом буферном электролите ( рН2), в котором концентрация нитрита натрия непрерывно менялась. По мере увеличения концентрации нитрита натрия в буферном электролите пассивация стали облегчается: потенциал пассивации смещается в отрицательную сторону, а токи пассивации падают. [44]
НаДс близки к 0, независимо от потенциала адсорбции подавляющая часть отщепившегося водорода будет, по-видимому, попадать на места прочно связанного водорода. Ионизации водорода на этих местах отвечают наиболее анодные потенциалы водородного участка кривой заряжения или потенциодинамической кривой. [45]
Страницы: 1 2 3 4