Потенциодинамическая кривая
Cтраница 4
Сигнал ФЭП при анодной поляризации изменяется экстремально. На кривой изменения ФЭП в зависимости от потенциала поляризации наблюдается один или два максимума в зависимости от состава стали, состава и температуры раствора. В большинстве случаев был зафиксирован л - тип проводимости окислов, возникающих в различных характерных зонах потенциодинамической кривой. [46]
Увеличение энергии связи прочносвязанного водорода особенно четко выражено при адсорбции ионов цинка. Последняя детально изучена нами с использованием изотопа Zn-65 на платиновом [29] и родиевом [30] электродах. Поэтому для объяснения результатов измерений кривых заряжения и потенциодина-мических кривых в присутствии ионов Zn2 необходимо располагать данными по адсорбции этих ионов в условиях, аналогичных условиям снятия кривых заряжения и потенциодинамических кривых. [47]
Потенциодйнамический метод характеризуется автоматической записью поляризационных кривых. Он необходим для быстрых измерений, чтобы избежать изменений состояния поверхности электрода и состава раствора. Однако потенциодинамические кривые не дают абсолютных ( для данной системы металл - раствор) значений характерных параметров ( pnac, пас, фп. [49]
 |
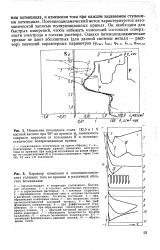
Гальваностатические кривые заряжения платинированного платинового электрода в 1 М растворах KF ( / КС1 ( 2 и КВг (.. [50] |
Отмеченная особенность адсорбированного кислорода вытеснять с поверхности другие адсорбированные вещества имеет большое значение для экспериментальной техники. Для того чтобы очистить поверхность платинового электрода от посторонних примесей, ее выдерживают несколько секунд или минут при потенциалах 1 1 - 1 4 В ( о. Если затем сдвинуть потенциал до 0 4 В, то кислород десорбируется и получается чистая поверхность. Очень чувствительным индикатором степени чистоты поверхности является форма потенциодинамической кривой заряжения ( см. рис. 12.13), которая искажается при наличии даже незначительного количества примесей. [51]
Точность определения Г методом хронопотенциометрии зависит от поправки на заряжение двойного слоя. Поэтому величины Г должны быть не очень малы. Для изучения адсорбции можно применять также и импульсный потенциодинамический ( осциллополярографический) метод. Однако преимущество хронопотенциометрии состоит в том, что омическое падение потенциала в растворе при снятии хронопотен-циограмм остается постоянным, поскольку / const, в то время как при снятии быстрых потенциодинамических кривых омическое падение потенциала оказывается различным для разных точек /, ф-кривой. [52]
При потенциалах водородной области на анодной потенциодинами-ческой кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается невыясненной. Низкие значения тока в интервале Ег 0 4 - - 0 7 В характеризуют двоинослоиную область платинового водорода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [53]
При потенциалах водородной области на анодной потенциодина-мической кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается не выясненной. Низкие значения тока в интервале фг 0 4 - н 0 7 в характеризуют двойнослойную область платинового электрода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [54]
При потенциалах водородной области на анодной потенциодинами-ческой кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается невыясненной. Низкие значения тока в интервале Ег 0 4 - - 0 7 В характеризуют двоинослоиную область платинового водорода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [55]
С другой стороны, если продолжить сравнеше поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионн должны не только ускорять активное растворение титана, но и облегчать процессы активации. Следует обратить внимание также на следующее обстоятельство. Значения могут характеризовать скорости растворения в пассивном состоянии. Поэтому в [ б ] такие соотношения п были связаны с растворением сплавов BTI-0 и 4200 только по данным анодных потенциодинамических кривых. С другой стороны, на потенциодинамических кривых может служить характеристикой не только скорости растворения, но и скорости образования оксидной пленки. В этой связи можно вспомнить работу [ гО ], в которой было установлено, что в 3 5 % растворе НаС1 в интервале значений рН 1 8 12 5 при 100 200 С легче всего образуется пассивная пленка ( анатаз) на сплаве т - 2 н; следующим по скорости роста пассивной пленки идет сплав к. [56]
Страницы: 1 2 3 4