Марголис
Cтраница 2
Следовательно, по мнению Марголис и Рогинского, эти альдегиды не могут быть главными промежуточными продуктами при образовании С02 как из самого этилена, так и из окиси этилена. Аналогичные работы [115] были проведены на катализаторе V2O5 при температуре 350 С. [16]
Некоторые авторы, включая Марголис [1] и Ройтера [49], отвергают окислительно-восстановительную схему. Они утверждают, что адсорбированный кислород, участвующий в каталитическом окислении, существенно отличается какотО2 - ( пов. Эта точка зрения, очевидно, оправдана в тех случаях, когда есть достаточные основания полагать, что в каталитической реакции принимают участие парамагнитные или диамагнитные кислородные формы. Но, как мы видели в предыдущей главе, нет никаких данных, которые указывали бы на то, что такие формы должны участвовать во всех окислительных каталитических процессах. [17]
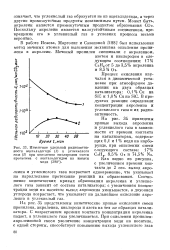 |
Изменение удельной радиоактивности ацетальдегида ( 1 и углекислого. [18] |
В работе Исаева, Марголис и Сазоновой [188] был использован метод меченых атомов для выяснения механизма окисления пропилена в акролеин. [19]
Мейзенхеймер и др. [24] и Марголис [25], изучавшие обмен между газообразным О и кислородом состава О16018 Оа8, предварительно адсорбированным на серебре, нашли, что десор-бирующийся кислород не был в равновесии с газовой фазой, и вначале заключили, что часть кислорода находится на поверхности в виде двухатомных молекул. Однако этот вывод был затем отвергнут, после того как Сандлер и Гиккам [26] показали, что эти экспериментальные результаты также могут быть объяснены наличием остаточного кислорода в металле. Сандлер и Дюригон [27], на основании своих данных по обмену, заключили, что адсорбированный кислород находится на поверхности серебра в двух состояниях, однако эти авторы не получили никаких указаний на то, что хотя бы одно из них представляет собой двухатомные частицы. Данные Борескова и др. [28], считающих, что адсорбированный слой на серебре энергетически однороден, указывают на две возможные модели: либо весь адсорбированный кислород диссоциирован на атомы, либо одно - и двухатомные формы присутствуют одновременно, но между ними существует быстро устанавливающееся равновесие. Данные по изотопному обмену на V2O6, полученные Йиру и Нова-ковой [29], указывают на существование на поверхности двухатомных кислородных форм. [20]
Согласно модели Ребиндера, Щукина и Марголис, при плотной кубич. [21]
В последнее время в нашей лаборатории Марголис, Крылова и Руфов [29, 30] изучили адсорбции углеводород-кислородных смесей при температурах ниже температуры катализа и показали, что одновременная адсорбция смесей протекает не так, как при последовательной адсорбции. [22]
На основании работ с применением меченых атомов Марголис и Рогинский [218] показали, что СО и СО2 образуются из олефинов через какие-то иные промежуточные соединения, но не через альдегиды и окиси. [23]
Тщательное изучение кинетики и механизма каталитического окисления простейших непредельных углеводородов на металлах и полупроводниках, осуществленное Марголис и Рогинским [85] с применением меченых атомов С14 и О18, привело к совершенно новым выводам по сравнению с широко распространенными представлениями о последовательном окислении, которые охарактеризованы выше ( см. стр. VI были приведены основные реакции окисления, происходящие главным образом в объеме. Для них катализатор или стенка сосуда служат прежде всего в качестве инициатора цепей, развитие же цепей происходит в объеме в результате статистического процесса столкновений свободных радикалов с молекулами. Для этих реакций представления о последовательном образовании стабильных продуктов разной степени окисления ( по крайней мере формально), очевидно, еще не утратили значения. Однако наряду с этими цепными реакциями имеются и такие, которые не только инициируются поверхностью, но протекают на ней. Поверхность от начала и до конца каталитического акта участвует в процессе окисления, образуя различные промежуточные поверхностные формы. Представления о последовательном образовании в ходе реакции устойчивых промежуточных продуктов возрастающей степени окисления, как показали Марголис и Рогинский, в этом случае оказываются несостоятельными. Каждый такой продукт окисления - альдегид, окись, кислота, СО, С02 - образуется параллельно другому по своему особому направлению превращений. [24]
Тщательное изучение кинетики и механизма каталитического окисления простейших непредельных углеводородов на металлах и полупроводниках, осуществленное Марголис ц Рогинским [85] с применением меченых атомов С14 и О18, привело к совершенно новым выводам по сравнению с широко распространенными представлениями о последовательном окислении, которые охарактеризованы выше ( см. стр. VI были приведены основные реакции окисления, происходящие главным образом в объеме. Для них катализатор или стенка сосуда служат прежде всего в качестве инициатора цепей, развитие же цепей происходит в объеме в результате статистического процесса столкновений свободных радикалов с молекулами. Для этих реакций представления о последовательном образовании стабильных продуктов разной степени окисления ( по крайней мере формально), очевидно, еще не утратили значения. Однако наряду с этими цепными реакциями имеются и такие, которые не только инициируются поверхностью, но протекают на ней. Поверхность от начала и до конца каталитического акта участвует в процессе окисления, образуя различные промежуточные поверхностные формы. Представления о последовательном образовании в ходе реакции устойчивых промежуточных продуктов возрастающей степени окисления, как показали Марголис и Рогинский, в этом случае оказываются несостоятельными. Каждый такой продукт окисления - альдегид, окись, кислота, СО, СО2 - образуется параллельно другому по своему особому направлению превращений. [25]
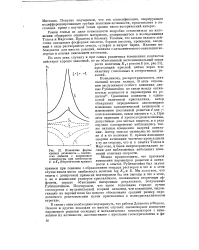 |
Изменение формы кривых активность - количество добавки с изменением температуры при симбатности Е и Ка ( теоретические кривые. [26] |
Рамки статьи не дают возможности подробно остановиться на изложении обширного опытного материала, содержащегося в исследованиях Тодеса и Марголис, Крылова и Элемент. Укажем, что весьма сильное действие оказывают фосфорная кислота, борная кислота, кремнезем, вводимый в виде растворимого стекла, сульфат и нитрат бария. Явление наблюдается для многих реакций, начиная с каталитического окисления водорода и кончая окислением изооктана. [27]
Бозон-Вердюра и Тешнера ( 6) для реакции гидрогенизации этилена на прокотированной литием и галлием окиси цинка и др. По данным, приведенным в докладе Марголис ( 19), для окисномедных катализаторов окисления пропилена в акролеин наблюдается корреляция в изменениях активности и работы выхода электрона при введении добавок; то же имеет место при введении добавок в ванадиевые катализаторы окисления бензола. В случае же глубокого окисления пропилена на кобальт-марганцевой шпинели и окислительного аммонолиза на висмут-молибденовых катализаторах введение добавок изменяет скорость реакции без корреляции с изменением работы выхода. [28]
Ферментное ингибирование в присутствии олигомеров кремневой кислоты может быть следствием либо направленности активных центров фермента в сторону кремнеземной поверхности, либо денатурации молекулы фермента по механизму Марголиса. Кинг и др. [280] сообщили, что подобным образом ингибируются ацетпл-холинэстераза, сукцинатдегидрогеназа, эстераза и гиалурони-даза; не подвержены ингибированию амилаза, панкреатическая липаза, пепсин, щелочные и кислые фосфатазы, трипсин и уреаза. [29]
Решение проблемы гетерогенного окисления этана усугубляется отсутствием глубоких исследований по механизму реакции. Марголис [33], трудность окисления предельных углеводородов может быть в какой-то мере объяснена их неспособностью образовывать промежуточные поверхностные каталитические комплексы, и наиболее часто в настоящее время гетерогенное превращение предельных углеводородов объясняется с позиций гомогенного механизма. [30]
Страницы: 1 2 3 4