Заполнение - поверхность - электрод
Cтраница 4
Одно из направлений модификации состояло в учете эффекта дискретности специфически адсорбированных ионов, который проявляется при малых заполнениях поверхности электрода. В других работах принималась во внимание зависимость диэлектрической проницаемости среды, в которой образуется двойной электрический слой, от напряженности электрического поля и природы ионов в растворе. [46]
В кинетических уравнениях поверхностную концентрацию адсорбированных частиц часто заменяют их объемной концентрацией, что допустимо в случае незначительных степеней заполнения поверхности электрода реагирующими частицами, когда справедлива изотерма адсорбции 1 енри. Однако коэффициент адсорбции в изотерме Генри, равно как и в случае других изотерм адсорбции, может изменяться с потенциалом электрода. [47]
 |
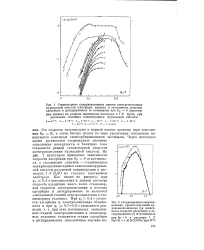
Зависимость заполнения поверхности электрода органическими частицами от потенциала электрода в 1 N HaSOi, содержащей разные количества метанола ( моль / л. [48] |
Однако при потенциалах отрицательнее 0 35 в или положительное 0 55 в по мере повышения объемной концентрации метанола в растворе заполнение поверхности электрода стремится не к единице, а к более низкому пределу OR, разному для различных потенциалов. [49]
Эта скорость максимальна в первый момент времени ( при заполнении 6к 0), а затем быстро падает по мере увеличения заполнения поверхности электрода хемосорбированными частицами. Через некоторое-время достигается стационарное значение заполнения поверхности и величина тока становится равной стационарной скорости электроокисления муравьиной кислоты. На рис. 1 пунктиром приведены зависимости скорости адсорбции при 6R 0 от потенциала, а сплошными линиями - стационарные поляризационные кривые окисления муравьиной кислоты различной концентрации в растворах 1 N H2SO на гладком платиновом электроде. Как видно из рисунка, при фг 0 4 в максимальная в данном растворе скорость адсорбции много выше стационарной скорости электроокисления и поэтому адсорбция и дегидрирование не являются замедленной стадией электроокисления в стационарных условиях. [51]
Это позволяет сделать общий вывод о том, что довольно трудно найти такие условия, когда реакция не будет существенно замедляться вследствие заполнения поверхности электрода. [52]
Если условно принять проницаемость диффузионного слоя P D / 8d № - 3 см / с, для ферментов третьей группы при монослойном заполнении поверхности электрода и при использовании концентраций субстрата, соизмеримых с Км, скорость ферментативной реакции существенно превысит скорость диффузии и фермент будет работать в строго диффузионном режиме. Уменьшение поверхностной концентрации фермента вплоть до 1 % заполнения поверхности не должно заметно изменить регистрируемую скорость процесса. [53]
 |
Скорость катодного оса - ли. щ ш. [54] |
Опыты, поставленные с полонием при его постоянной концентрации, показали постоянство скорости осаждения, что говорит о независимости последней величины от степени заполнения поверхности электрода осаждаемым элементом. [55]
Вследствие большого различия в интенсивности межмолекулярного взаимодействия обычные адсорбционные слои с а2 и двумерные конденсированные слои имеют существенно различное строение при малых степенях заполнения поверхности электрода. Органические вещества с а2 образуют газообразные слои, в то время как вещества с а2 образуют ассоциаты, кластеры и адсорбционный слой ПАОВ имеет гетерогенную структуру. На границе свободной поверхности и кластера ПАОВ в неравновесных условиях могут возникать значительные градиенты поверхностного натяжения, что приводит к гидродинамической неустойчивости межфазной границы электрод / раствор и появлению полярографических максимумов тока третьего рода ( см. гл. [56]
В первоначальном выводе Вебера, Коутецкого и Кориты [ 1 предполагалась быстрая адсорбция сильно адсорбирующегося поверхностно-активного вещества и линейная зависимость константы скорости реакции от заполнения поверхности электрода. [57]
Эти допущения справедливы лишь в случае незаряженных поверхно-стноактивных веществ; в присутствии поверхностноактивных веществ ионного типа необходимо учитывать еще изменение отдельных констант скорости с заполнением поверхности электрода. [58]
Страницы: 1 2 3 4