Зарождение - свободный радикал
Cтраница 3
Это следует и из чисто качественных соображений. Действительно, из самого определения неразветвленной цепной реакции ясно, что скорость зарождения свободных радикалов ( активных центров) равна скорости их обрыва, а так как в результате актов продолжения цепи число свободных радикалов не подвергается изменению, то, в целом, неразветвленная цепная реакция на значительном своем протяжении протекает при сохранении стационарной концентрации свободных радикалов, а следовательно, и постоянной скорости реакции. [32]
Проведенное нами сопоставление экспериментальных и расчетных данных показало, что результаты опыта в основном находятся в соответствии с выводами цепной теории. Не подлежит сомнению, что инициирующая роль двуокиси азота заключается в существенном облегчении процесса зарождения свободных радикалов. [33]
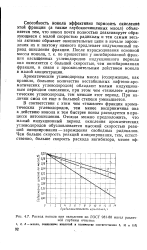 |
Расход ионола при окислении по ГОСТ 981 - 80 масел различ. [34] |
В соответствии с этим чем тяжелее фракция ароматических углеводородов, тем менее восприимчива она к действию ионола и тем быстрее ионол расходуется в процессе автоокисления. Отсюда можно предположить, что малый индукционный период окисления ароматических углеводородов обусловливается высокой скоростью реакций инициирования - зарождения свободных радикалов. [35]
С другой стороны, благодаря развитию современных спектральных методов исследования сейчас накоплен обширный экспериментальный материал относительно структуры дефектов на поверхности окислов и природы различного рода адсорбированных свободных радикалов. Целью настоящей работы является рассмотрение этих результатов и обсуждение возможности их использования для более глубокого понимания механизма зарождения свободных радикалов на поверхности окислов. [36]
Показано, что скорость образования свободных радикалов в тройных системах и-ксилол ( или ме-тилтолуилат) СоЬ2 02 прямо пропорциональна концентрации каприлата кобальта. Это подтверждает факт участия одной молекулы катализатора в электронном акте зарождения цепей. В отсутствие n - ксилола или метилтолуилата начальная скорость зарождения свободных радикалов W0 не равна нулю, что подтверждает предположение об активации кислорода под действием катализатора. [37]
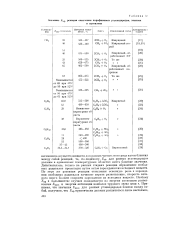 |
Значение А1 реакции окисления парафиновых углеводородов, этилена. [38] |
Еаф для разных углеводородов должны в одинаковых температурных областях иметь близкие значения. Действительно, только на ранних стадиях реакции образование свободных радикалов происходит путем актов зарождения из исходных веществ. По мере же развития реакции окисления основную роль в зарождении свободных радикалов начинает играть разветвление, скорость которого много больше скорости зарождения из исходных веществ. [39]
Фтор известен своей поразительной активностью. Даже при низких температурах ( 0 и ниже) он быстро реагирует ( часто со взрывом) со многими органическими соединениями. Такая большая активность фтора, а также разнообразие продуктов реакции фторирования галоидоолефинов вряд ли могут быть объяснены непосредственным взаимодействием фтора и олефина с образованием молекулярных продуктов реакции. Ряд фактов свидетельствует о том, что эти реакции происходят с образованием свободных радикалов. Зарождение свободных радикалов путем распада F2 на атомы практически невозможно, поскольку энергия диссоциации фтора составляет 37 ккал. Легко убедиться, что при температурах близких 0 вследствие диссоциации молекулы фтора образуется менее одного атома фтора в секунду. [40]
Аналогичное двойственное действие оказывает также частица NO. Она является скрытым радикалом, активность которого при низких температурах очень мала, вследствие того, что валентный электрон расположен между N и О, обеспечивая дополнительную одноэлектронную связь между ними. При встрече со свободными радикалами цепи N0 легко к ним присоединяется. Вследствие этого N0 является сильным замедлителем большого числа цепных реакций. Однако в некоторых случаях окись азота действует и как ускоритель. Ускоряющее действие N0 проявляется при повышенных температурах, когда N0, как очень слабый радикал, становится способным реагировать с молекулами исходных веществ, зарождая таким образом свободные радикалы. Здесь зарождение свободных радикалов при взаимодействии СНдСНО с NO происходит легче, чем непосредственный разрыв связей С - С или С - Н в молекуле альдегида. Характер подобных реакций неясен; не исключена возможность протекания их на стенке сосуда. [41]
Страницы: 1 2 3
