Эффективный заряд - ядро
Cтраница 2
 |
Система Притчарда-Скиннера. [16] |
Упрощенный метод расчета эффективного заряда ядра, примененный Горди, не позволил вскрыть специфику электронного строения атомов неблагородно-газового типа и потому значения электроотрицатель-ностей, по Горди, для элементов Ь - подгрупп существенно ниже термохимических величин. [17]
Заряд Z-S называется эффективным зарядом ядра. Явление экранирования можно было бы понять и с позиций теории Бора, но специфические волно-механические свойства электрона обнаруживаются в особенностях эффекта экранирования для различных волновых функций. [18]
Например, в ионе Li эффективный заряд ядра, действующий за пределами расстояния 1 - 2 ат. [20]
У какого элемента заряд и эффективный заряд ядра равны. [21]
Далее будут приведены другие значения эффективных зарядов ядер по Слэтеру. [22]
Что называют коэффициентом экранирования, полным и эффективным зарядом ядра. В каком соотношении они находятся друг с другом. [23]
Для какого из элементов заряд и эффективный заряд ядра равны. [24]
В методе Слейтера - Ценера и эффективный заряд ядра Z и главное квантовое число п для каждой орбитали рассматриваются как параметры, которые выбирают так, чтобы полна я энергия атома была минимальна. Однако для атомов элементов первой половины периодической таблицы п принимает целочисленные значения. Каждая орбиталь имеет такую же угловую часть, как АО водорода [ см. уравнение (4.1) ], поэтому любую орбиталь можно характеризовать теми же тремя квантовыми числами п, I и т, как и соответствующую орбиталь водорода, и использовать для них те же самые символы. [25]
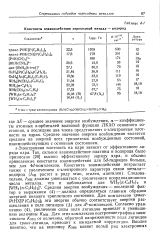 |
Константы взаимодействия переходный металл - водород. [26] |
Электронная плотность на ядре зависит от эффективного заряда ядра. Так, сильное взаимодействие платины и водорода было приписано [20] высоко эффективному заряду ядра, и обычно приведенные константы взаимодействия для Sd-гидридов больше, чем для 4й - комплексов. Средняя энергия возбуждения - последний фактор в выражении ( 4) - должна определяться главным образом энергией низшего триплетного состояния. Для комплексов транс - PtHXlPtCaHsbb эта энергия обычно соответствует энергии расщепления в поле лигандов ( Д) для - комплексов. Согласно уравнению ( 4), увеличение силы поля лигандов приведет к уменьшению величины / Смн. Для этих комплексов построение графика зависимости / Смн от величины, обратной напряженности поля лигандов для г / зонс-лиганда, приводит к ожидаемой корреляции. [27]
 |
Потенциалы ионизации элементов. [28] |
Кроме того, оно зависит от эффективного заряда ядра: чем больше эффективный заряд ядра Z3 § §, притягивающий электрон, тем больше понижается энергия электрона, когда он поступает извне на орбиталь атома. Поскольку при переходе вдоль одного периода от элементов группы I к элементам группы VII радиусы атомов последовательно уменьшаются, а 2эфф возрастает, сродство к электрону должно быть максимальным у элементов седьмой группы. В пределах одной группы сродство к электрону обычно имеет наивысшее значение для наиболее легкого элемента. Однако элементы F, О и N характеризуются настолько низкими значениями сродства к электрону, что выпадают из общей закономерности. Это объясняется маленькими размерами указанных атомов, вследствие чего у них очень велика электронная плотность. Поскольку, например, в атоме фтора на каждый электрон действует большой эффективный заряд ядра Z3ty, электронное облако у фтора оказывается чрезвычайно плотным. Добавление еще одного электрона с образованием иона F настолько повышает отталкивание между электронами, что сродство электрона к фтору оказывается меньше, чем у следующего элемента той же группы, хлора. То же самое происходит с маленькими, компактными атомами кислорода и азота. [29]
Все это привело к введению понятия эффективного заряда ядра - Z, который меньше полного заряда ядра на некоторую величину, называемую числом ( чаще константой) экранирования - а: Z Z - a [ Slater, I960; Clementi, Raimondi, 1963; Бацанов, Звягина, 1966; Щукарев. [30]
Страницы: 1 2 3 4
