Кривое заряжение
Cтраница 1
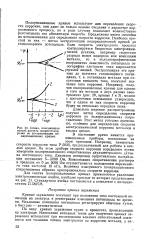 |
Схема, поясняющая способ расчета скорости коррозии по экстраполяции поляризационных кривых. [1] |
Кривые заряжения получают при наложении тока постоянной ве - личины на электрод и регистрации изменения потенциала во времени. Медленные изменения потенциала регистрируют обычным путем, а быстрые - автоматически. [2]
 |
Схема ячейки для измерения кривых заряжения. [3] |
Кривые заряжения рис. 2 и 3 показывают, что во всех растворах катодная и анодная кривые не совпадают при любых значениях потенциала. [4]
Кривые заряжения могут сниматься при наложении анодного и катодного тока. Этот метод исключает длительное протекание электрохимического процесса на исследуемом электроде при постоянном потенциале, так как последний непрерывно меняется в зависимости от количества пропущенного электричества. [5]
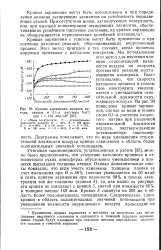 |
Кривые заряжения медного катода, снятые в 0 1 - н. растворе NaCl при i 140 мка / см2. [6] |
Кривые заряжения могут быть использованы и при определении влияния легирующих элементов на устойчивость нержавеющих сталей. [7]
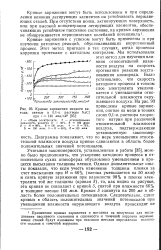 |
Кривые заряжения медного катода, снятые в 0 1 - н. растворе NaCl при i 140 мка / см2. [8] |
Кривые заряжения с успехом могут быть применены и при изучении катодных реакций, обусловливающих коррозионный процесс. Этот метод пригоден в тех случаях, когда процессы коррозии протекают с катодным контролем. [9]
Кривые заряжения, измеренные на золоте, имеют две различимые задержки. [10]
Кривые заряжения могут быть получены также методом быстрого заряжения, когда на электрод подается большая плотность тока, а зависимость потенциал - время регистрируется осциллографом. За малое время снятия кривой растворенный молекулярный водород не успевает продиффундировать к поверхности электрода и, таким образом, не вызывает роста тока ионизации. Предотвращения влияния молекулярного водорода можно добиться, используя электроды со сравнительно малой истинной поверхностью в контакте с очень малым объемом раствора, в котором общее количество растворенного водорода столь незначительно, что существенно не сказывается на результатах измерений. [11]
Кривые заряжения позволяют получить ряд характеристик катализаторов, имеющих важное значение для катализа. К их числу относятся: 1) адсорбционная способность катализатора по отношению к водороду и кислороду, определяемая по количеству электричества, пошедшего на их ионизацию; 2) истинная поверхность - по количеству электричества, пошедшего на заряжение двойного слоя, при условии, что известна емкость 1 см2 поверхности этого металла в данном электролите: 3) относительная энергия связи адсорбированного водорода - по количеству работы, затраченной на его ионизацию, которая вычисляется как площадь под кривой заряжения; 4) дифференциальные теплоты адсорбции водорода - по изменению хода кривых заряжения с температурой, по уравнению Клаузиуса-Клапейрона. [12]
Кривые заряжения имеют две площадки ( рис. 23), что свидетельствует об адсорбции частиц двух типов. [13]
Кривые заряжения, подобные показанной на рис. 33, могут быть получены и в других растворах, в частности в растворах H2S04 и КОН. [14]
 |
Схема ячейки для измерения кривых заряжения. [15] |
Страницы: 1 2 3 4 5