Измерение - скорость - реакция
Cтраница 2
Измерение скорости реакции Н2 с 02 проводили на образцах окиси цинка, предварительно выдержанных в кислороде при давлении 150 мм рт. ст. и при температуре реакции в течение пятнадцати минут. [16]
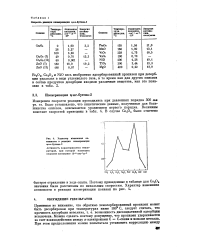 |
Характер изменения активности в реакции изомеризации Ч - бутена-2. [17] |
Измерения скорости реакции проводились при давлениях порядка 300 мм рт. ст. Было установлено, что кинетические данные, полученные для большинства окислов, описываются уравнением первого порядка. [18]
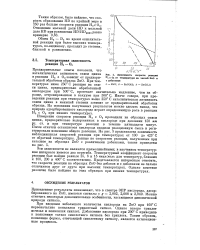 |
Зависимость скорости реакция Н2 с Оа от температуры на чистой ZnO и с добавками 1 - ZnO. 2 - ZnO ( Al. 3 - ZnO ( Li. [19] |
Измерение скорости реакции Н2 с 02 проводили на образцах окиси цинка, предварительно выдержанных в кислороде при давлении 150 мм рт. ст. и при температуре реакции в течение пятнадцати минут. [20]
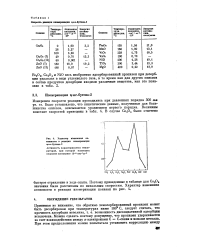 |
Характер изменения активности в реакции изомеризации Ч - бутена-2. [21] |
Измерения скорости реакции проводились при давлениях порядка 300 мм рт. ст. Было установлено, что кинетические данные, полученные для большинства окислов, описываются уравнением первого порядка. [22]
Измерение скорости реакции в диффузионной области ничего не может сказать нам об истинной кинетике реакции и ее химическом механизме. Но зато измерение скорости реакции в диффузионной области может служить методом исследования диффузионных процессов, в частности конвективной диффузии. [23]
Измерение скорости реакции в лабораторном масштабе обычно осуществляется в условиях, исключающих влияние побочных факторов. Как правило, исследования ведутся при постоянных температуре, давлении и интенсивном перемешивании. Полученные таким образом кинетические данные очень полезны для изучения механизма реакции, но, как правило, не касаются количественной оценки скорости процесса. [24]
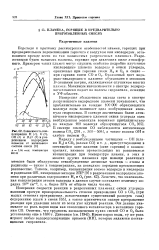 |
Зависимость концентрации Н ( 1, О ( 2, ОН ( 3 и Н20 ( 4 в разреженном водородном пламени от начального состава смеси. [25] |
Измерения скорости реакции в разреженных пламенах окиси углерода выявили прямую пропорциональность степени превращения СО в СО2 ( при малых степенях превращения, исключающих существенный разогрев газа) содержанию влаги в смеси [65], а также практически полное прекращение реакции при удалении влаги из зоны уже идущей реакции. Эти данные указывают на роль паров воды как гомогенного катализатора в механизме горения СО. Кроме паров воды, ту же роль играют любые водородсодержащие примеси ( RH), которые являются поставщиками гидроксила. [26]
Измерение скорости реакции во время нестационарного периода или во время пре - или пост-эффекта дает, однако, как и в случае бимолекулярного обрыва, необходимые дополнительные соотношения [ именно численные значения kpl ( kt - - k ], что позволяет рассчитать константы скоростей. [27]
Измерение скорости реакции основано на определении концентрации одного из реагирующих веществ через различные промежутки времени с момента начала реакции. Выбор вещества, концентрация которого контролируется в ходе реакции, диктуется соображениями удобства. [28]
Измерение скорости реакции в растворе является основой одного из более новых методов химического анализа. Рассмотрение реакций с точки зрения их кинетики означает принципиальное изменение философии химиков-аналитиков, поскольку до сих пор они считали заслуживающими внимания только равновесные системы, а любые медленные процессы зачислялись главным образом в разряд потенциальных аналитических реакций. [29]
Измерения скорости реакции на образцах катализаторов различного зернения показали, что при размерах зерна меньше 1 5 мм реакция протекает в чисто кинетической области. Все исследования, о которых будет идти речь ниже, проведены на катализаторах с размерами зерна 0 5 - 1 мм. [30]
Страницы: 1 2 3 4