Элементарный анион
Cтраница 2
Как показывают эти примеры, поляризуемость элементарного аниона вследствие образования соединения с положительно заряженным ионом понижается тем сильнее, чем меньше радиус и чем выше положительный заряд последнего и чем сильнее свободный анион поляризуем. Чем более сильное поляризующее действие оказывает положительный ион на связанный с ним анион, тем меньшему дополнительному влиянию этот анион подвергается со стороны другого электрического поля. [16]
Как показывают эти примеры, поляризуемость элементарного аниона вследствие образования соединения с положительно заряженным ионом понижается тем сильнее, чем меньше радиус и чем выше положительный заряд последнего и чем сильнее свободный анион поляризуем. [17]
Определяемые из кристаллических решеток эффективные радиусы элементарных анионов оказываются, как правило, меньше радиусов отвечающих им инертных газов, причем величины для двухвалентных ионов еще меньше, чем для одновалентных. Так как при переходе: от атома инертного газа к соответствующему одно - и затем двухзарядному аниону число электронов и их расположение остаются неизменными, а заряд ядра уменьшается, радиусы частиц в рассматриваемых рядах должны были бы увеличиваться. [18]
 |
Ионный потенциал и химические свойства гидроокисей.| Схема влияния силы дают постоянным диполем. Это обстоятельство позво-поля на общую поляризацию. [19] |
Таким путем в общую таблицу могут быть включены и элементарные анионы. [20]
Элементарные анионы проявляют только восстановительные свойства. [21]
Однако элементарные анионы проявляют только восстановительные свойства. [22]
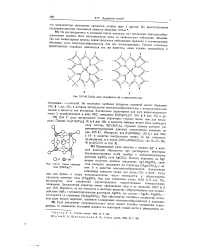 |
Схема яле -. р хлорофилла ( Л и гемоглобина ( В.| Схема строения иона [ F ( SbF3 4J -. [23] |
Из рассмотренного в основном тексте вытекает, что типичными комплексообра-зователями должны быть многозарядные ионы со сравнительно небольшим объемом. Так как элементарные анионы характеризуются небольшими зарядами и значительными объемами, роль комплексообразователя для них малохарактерна. [24]
Из рассмотренного в основном тексте вытекает, что типичными комплексооб-разователями должны быть многозарядные ионы со сравнительно небольшим объемом. Так как элементарные анионы характеризуются небольшими заряда ми и значительными объемами, роль комплексообразо-вателя для них малохарактерна. Однако отдельные представители подобных комплексов все же известны, даже помимо аммонийных и оксониевых соединений. Из последних наиболее интересен основной ацетат бериллия ( XII § 1 доп. Значительно характернее для него координационное число 3, проявляющееся в ионе ОН3, комплексе [ O ( HgCl) 3 ] Cl ( XII § 4 доп. [25]
Из рассмотренного ранее ( IX § 2) вытекает, что типичными комплексо-образователями должны быть многозарядные ионы со сравнительно небольшим объемом. Так как элементарные анионы характеризуются небольшими зарядами и довольно значительными объемами, роль комплексообразователя для них мало характерна. Однако отдельные гпедставители подобных комплексов все же известны. Например, растворением Agl в концентрированном растворе AgNOs можно получить двойное соединение AgI - 2AgNO3, результаты изучения которого указывают на структуру [ IAg3 ] ( NO3) 2 с ионом 1 - в качестве комплексообразователя. [26]
Из рассмотренного ранее ( IX § 2) вытекает, что типичными крмплексооб-разователями должны быть многозарядные ионы со сравнительно небольшим объемом. Так как элементарные анионы характеризуются небольшими зарядами и довольно значительными объемами, роль комплексообразователя для них мало характерна. Однако отдельные представители подобных комплексов все же известны. J - в качестве комплек-сообразова. [27]
Металлы корродируют в расплавленных солевых средах вследствие присутствии окислителей. Следует отметить, что элементарные анионы, как, например, галогенид-ионы ( F -, Cl -, Br -, J -), находясь в предельной степени восстановления, никогда не могут выступать в роли окислителей. Это обстоятельство - следует иметь в виду при выборе композиций солевых сред, а также при объяснении процессов коррозии. [28]
Радиусы атомов, например, азота и фосфора меньше, а энергия ионизации больше, чем у атомов углерода и кремния; незначительно и сродство к электрону. Поэтому азот и фосфор не образуют элементарных катионов и обычно не превращаются в элементарные анионы. [29]
Последнее, несомненно, и отвечало бы результатам опыта, если бы определение эффективных радиусов можно было произвести на свободных анионах. Действие этих сил не может не сказаться на уменьшении эффективных радиусов, и уменьшении тем большем, чем больше заряды ионов. Таким образом, результаты опытного определения эффективных радиусов элементарных анионов не противоречат основным представлениям теории строения атомов. [30]
Страницы: 1 2 3