Электрохимическое измерение
Cтраница 3
Одновременно с электрохимическими измерениями проводят анализ Коррозионной среды отбора проб. Для этого на пробковом кране монтируют зонд, состоящий из манометра, пробоотборного вентиля, кассет с плоскими и круглыми образованиями. [31]
Если при электрохимических измерениях возможны одновременно химический анализ и оптические измерения, то желательно производить совместные измерения. Это позволяет устранить неясности, которые часто возникают при электрохимических способах измерения толщины поверхностной пленки. [32]
Применяемые в электрохимических измерениях мембраны могут принадлежать к различным типам. Некоторые из них сравнительно инертны, как, например, мембраны из ацетата целлюлозы или полимерных материалов. Ионообменные мембраны имеют заряженные группы, связанные с матрицей. Следовательно, они стремятся вытеснить ионы того же заряда, что и связанный. [33]
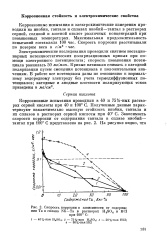 |
Скорость коррозии в зависимости от содержания Та в сплава Nb-Та в растворах H2SO4 и НС1 при 100 С. [34] |
Коррозионные испытания и электрохимические измерения проводили на ниобии, тантале и сплавах ниобий-тантал в растворах серной, соляной и азотной кислот различных концентраций при повышенных температурах. [35]
Таким образом, электрохимические измерения принципиально по-новому освещают механизм действия медьсодержащей оксида-зы. Ниже представлены результаты изучения кинетики гомогенного окисления лакказой субстратов различной природы, сопоставлены электрохимические и химико-кинетические измерения с целью получения более полной картины молекулярного механизма действия катализатора. [36]
В этих условиях электрохимические измерения позволяют определить константу скорости соответствующей химической реакции. Однако в настоящее время кинетика ионных реакций в основном исследуется релаксационными методами. [37]
Для любого рода электрохимических измерений необходима электрохимическая цепь или электрохимическая ячейка, составной частью которой является анализируемый раствор. [38]
Эти данные получены путем электрохимических измерений и их следует считать приближенными. [39]
В результате своих электрохимических измерений Кьюккола смог определить энтальпию, свободную энергию п энтропию изученных окислов урана, а также эти же термодинамические функции для реакций образования высших окислов урана из LIO. [40]
 |
Потенциалы электродов сравнения по отношению к стандартному водородному электроду при 25 С. [41] |
Наиболее часто при электрохимических измерениях в водных растворах применяют водородный, каломельные, галогенсеребряные и оксидно-ртутный электроды сравнения. Потенциалы электродов сравнения по отношению к нормальному водородному электроду представлены в табл. 1.2. В некоторых случаях создают специальные электроды сравнения, обратимые по отношению к аниону или к катиону. [42]
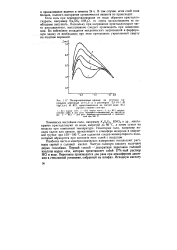 |
Поляризационные кривые на ртутном капельном электроде ( т1 5 с в растворах 2 5 - 10 - 4 М HgCI2 l M KCI, приготовленных на чистой воде, КС1 разной степени очистки. [43] |
Наиболее часто в электрохимических измерениях используют растворы серной и соляной кислот. Чистую соляную кислоту получают двумя способами. Первый способ - двукратная перегонка соляной кислоты марки хч, которая представляет собой 37 % - ный раствор НС1 в воде. Перегонка производится два раза при атмосферном давлении в стеклянной установке, собранной на шлифах. [44]
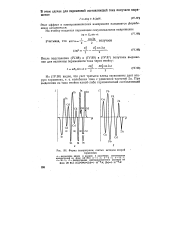 |
Форма полярограмм, снятых методом второй гармоники. [45] |
Страницы: 1 2 3 4