Изобара - адсорбция
Cтраница 4
При Г const уравнение ( XIII, 13) является изотермой, а при р const - изобарой адсорбции на широко неоднородной поверхности. [46]
 |
Значения предельных объемов. [47] |
Теория объемного заполнения микропор позволяет по одной экспериментальной изотерме адсорбции, измеренной при некоторой температуре или по одной изобаре адсорбции рассчитать изотермы этого же вещества для других температур. Проведенные различными авторами исследования по адсорбции веществ на микропористых углеродных адсорбентах в рамках ТОЗМ давали хорошее совпадение расчетных и экспериментальных данных, когда предельный объем адсорбционного пространства, оцененный по бензолу, распространялся на вещества, молекулы которых близки по размерам молекулам стандартного вещества. [48]
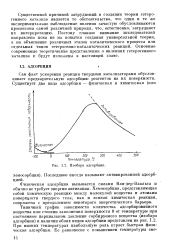 |
Изобара адсорбции. [49] |
Типичный график зависимости количества адсорбированного вещества или степени заполнения поверхности 6 от температуры при постоянном парциальном давлении сорбируемого вещества ( изобара адсорбции) и наличии обоих видов адсорбции представлен на рис. 1.2. При низких температурах наибольшую роль играет быстрая физическая адсорбция. [50]
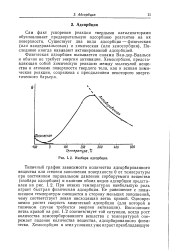 |
Изобара адсорбции. [51] |
Типичный график зависимости количества адсорбированного вещества или степени заполнения поверхности 0 от температуры при постоянном парциальном давлении сорбируемого вещества ( изобара адсорбции) и наличии обоих видов адсорбции представлен на рис. 1.2. При низких температурах наибольшую роль играет быстрая физическая адсорбция. Ее равновесие с повьь шением температуры смещается в сторону меньших заполнений, чему соответствует левая нисходящая ветвь кривой. Восходящая ветвь кривой на рис. 1.2 соответствует той ситуации, когда рост количества хемосорбированного вещества с температурой опережает падение количества вещества, адсорбированного физически. [52]
Сивертс и Роэль [75] первыми исследовали изотермы адсорбции на пробах металлических порошков, содержащих 91 % циркония, при температурах 800 и 1100 С и изобару адсорбции при давлении водорода 760 мм рт. ст. Однако с помощью примененного ими метода трудно было получить удовлетворительные результаты. [53]
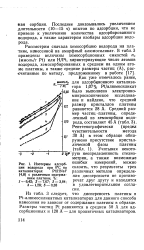 |
Изотермы адсорб. [54] |
Последнее доказывалось увеличением длительности ( 10 - 15 ч) опытов по адсорбции, что не привело к увеличению количества адсорбированного водорода, а также характером изобары адсорбции водорода. [55]
Так как в обоих случаях теплоты адсорбции положительны, то при условии установления истинного адсорбционного равновесия с точки зрения термодинамики можно было бы ожидать, что на изобарах адсорбции не будет максимумов и эти изобары будут монотонно уменьшаться с повышением температуры. Часто наблюдаемые на изобарах максимумы следует приписать тому обстоятельству, что в условиях, когда одновременно протекают два типа адсорбции, за время опыта не удается достигнуть истинного равновесия. [56]
Зависимость адсорбции от объемной концентрации адсорбата ( или в случае газов от давления) при постоянной температуре называют изотермой адсорбции, а зависимость адсорбции от температуры при постоянной концентрации - изобарой адсорбции. По виду изотермы адсорбции интерпретируют адсорбционные данные. При монослойной адсорбции изотермы обычно представляют в виде 8 / / ( су. [57]
Влияние температуры на молекулярно-ситовое действие очень ярко видно на примере адсорбции кислорода, аргона и азота на цеолите NaA при низких температурах. Изобары адсорбции этих газов представлены на рис. 8.15. Хотя кинетический диаметр молекулы азота всего на 0 2 А больше, чем у кислорода, этой небольшой разницы достаточно для того, чтобы азот не адсорбировался при низких температурах или адсорбировался крайне медленно. При температурах выше - 100 С азот адсорбируется в больших количествах, чем кислород. Аргон ведет себя так же, как азот, но он начинает адсорбироваться при более низкой температуре. Таким образом, при низких температурах азот и аргон с большим трудом диффундируют в цеолит NaA, и за время опыта адсорбционное равновесие не устанавливается. Изменение моле-кулярно-ситового действия с температурой объясняется следующими причинами: 1) диффузия как активационный процесс является функцией температуры или 2) повышение температуры усиливает колебания атомов кислорода, окружающих окна в каркасе цеолита. [58]
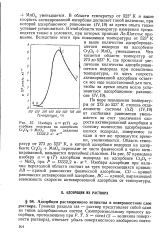 |
Изобара а - р ( Т адсорбции водорода на адсорбенте - поэтому количество адсорбировав - Сг2О3 МпО2 при давлении шегося водорода, измеряемое за 13332 2 н - лт один и тот же промежуток време. [59] |
Область температур от 273 до 523 К, в которой адсорбция водорода на адсорбенте Сг2О3 МпО2 переходит от чисто физической к чисто активированной, называется переходной областью. Изобара адсорбции при наличии переходной области состоит из трех пересекающихся кривых: А В - кривой равновесия физической адсорбции, CD - кривой равновесия активированной адсорбции, ВС - кривой, выражающей зависимость скорости активированной адсорбции от температуры. [60]
Страницы: 1 2 3 4 5