Посторонний анион
Cтраница 3
На образование растворимых полиядерных гидроксокомплексов оказывает большое влияние присутствие посторонних анионов. В случае анионов, сильно координируемых ионами алюминия и не замещающихся гидроксид-ионами, с повышением их концентрации рН максимального осаждения гидроксида алюминия снижается. Если анионы образуют прочные связи с ионом алюминия, но замещаются гидроксид-ионом, то рН максимального осаждения А1 ( ОН) з повышается основными и снижается слабоосновными анионами. Очень прочные связи образуют ионы алюминия с рядом органических лигандов, что затрудняет протекание процесса коагуляции и требует увеличения дозы коагулянта. [31]
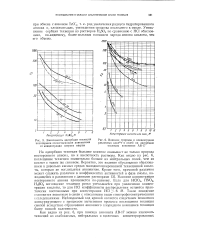 |
Зависимость адсорбции технеция.| Влияние природы и концентрации. [32] |
На адсорбцию технеция большое влияние оказывает не только природа постороннего аниона, но и кислотность раствора. Как видно из рис. 6, поглощение технеция значительно больше из нейтральных солей, чем из кислот с таким же анионом. Вероятно, это явление обусловлено образованием в довольно кислых средах малодиссоциированной технециевой кислоты, которая не поглощается анионитом. Влияние концентрации постороннего аниона проявляется по-разному. Такое поведение становится понятным в связи с описанными выше спектрофотометрическими исследованиями. Наблюдаемый ход кривой является следствием появления конкурирующего с процессом вытеснения процесса поглощения технеция смолой вследствие образования анионного хлоридного комплекса технеция более низкой валентности. [33]
Если исходить из представлений, что с ростом концентрации постороннего аниона активная часть поверхности электрода увеличивается, то, очевидно, при некоторой концентрации следует ожидать предельной для данных условий активации поверхности. В связи с этим можно предположить, что в области, где концентрация посторонних анионов не влияет на скорость неполного восстановления, поверхность электрода является предельно активной. Действительно, если на первом участке кривой скорость восстановления зависит от природы аниона, то при достижении предельной для данных условий активации поверхности ни природа аниона, ни его концентрация практически не оказывают влияния на скорость восстановления. [34]
В дальнейших исследованиях [7] было высказано представление о механизме влияния посторонних анионов на неполное восстановление хромат-ионов. Предполагают, что анионы SOf -, C1 - и F -, адсорбируясь на окисленной поверхности катода и образуя растворимые комплексы, способствуют возникновению активных центров. Комплексы, переходя в раствор, обнажают чистую поверхность металла, на которой и происходит восстановление хромат-ионов. По мнению автора, влияние катодной пленки на восстановление хромат-ионов до металла проявляется не только в торможении конкурирующих процессов ( VIII. [35]
Обычно присутствие в растворе, содержащем анализируемые ионы металлов, посторонних анионов, способных к образованию комплексных соединений, может оказывать влияние на экстракционное равновесие. Поэтому схема разделения, осуществляемая в растворах НС1, при введении ионов SO - в исследуемый раствор может искажаться. Установлено, что при введении в растворы ванадия ( V) и железа ( III) 8 - 10 М по НС1 сульфатов в виде H2SO4 или Na2SO4 до соотношения 1: 100 по отношению к ионам металлов экстракция и элюирование происходят обычным путем. С увеличением SO - до 1: 200 и выше коэффициенты распределения уменьшаются, а при 1: 500 и более ионы ванадия и железа не экстрагируются. [36]
Действие галоидов на двойные связи становится более сложным, если присутствуют посторонние анионы, на которые промежуточный карбонатной может проводить атаку предпочтительнее, чем на галоидные анионы. [37]
Основными компонентами хромового электролита являются хромовые кислоты Н2СгО4 и НаСгаСЬ, посторонние анионы SO42 - и SiFe2 - и соединения трехвалентного хрома. [38]
Преимущества саморегулирующихся электролитов следующие: стабильность состава, так как концентрация постороннего аниона поддерживается автоматически; более высокая СП по сравнению со стандартным электролитом; практическая независимость ВТ от % ( выше 40 А / дм2) и t ( выше 50 С); широкий интервал изменения / и гк, обеспечивающий получение блестящих осадков; более высокая PC по сравнению со стандартным электролитом. [39]
Таким образом, при электролизе водного раствора хромовой кислоты в присутствии посторонних анионов происходит разложение воды и хромового ангидрида. [40]
 |
Схема рН - образования комплексов алюминия с алюминоном ( а и с ализарином ( б и рН - изменения цвета свободных реактивов. [41] |
Для решения вопроса пригодности того или другого метода определения в присутствии посторонних анионов необходимо знать константы нестойкости комплексов определяемого иона с реактивом и с посторонним ионом. Если концентрации анионов реактива и мешающих анионов одного порядка, то определение возможно только в том случае, если константы нестойкости комплекса определяемого иона с реактивом значительно меньше по сравнению с константой нестойкости комплекса определяемого иона с мешающим анионом. Так, в нашем примере / CpescN - КреС1, но / CpescN2 3 / Срер - Поэтому определение железа в виде роданида в присутствии хлоридов возможно, хотя и с некоторой ошибкой. Определение же железа в присутствии фторида произвести нельзя, так как фторид связывает железо в бесцветный комплекс. [42]
 |
Области образования хромо Т, С вых осадков в зависимости от температуры и плотности тока 50. [43] |
Для начала осаждения металлического хрома необходимо наличие в электролите небольшого количества посторонних анионов 5ОГ, SiFe и других и хрома в трехвалентной форме. [44]
Основными компонентами хромового электролита являются хромовые кислоты Н2СгО4 и Н2Сг2О /, посторонние анионы SO42 - и SiFe2 - и соединения трехвалентного хрома. [45]
Страницы: 1 2 3 4