Образующийся анион
Cтраница 2
Благодаря электроноакцепторным свойствам карбонильная группа стабилизирует образующийся анион и тем самым облегчает кислотную диссоциацию карбоксильной группы. [16]
Гидрофобный катион Т удерживателя препятствует переходу образующихся анионов в водную фазу. [17]
Из этого можно сделать вывод, что образующийся анион однозарядный, а не двухзарядный ( В4О7 - и HB5Og -), как полагает Карпени. [18]
Кислотность ароматических протонов ( фактически определяемая стабильностью образующегося аниона) зависит от индуктивного эффекта заместителей. Поэтому элек-троноакцепторные группы, как, например, ОСН3, стабилизируют анионы орто мета пара, тогда как СН3 - группа, обладающая электронодонорным индуктивным эффектом ( слабый эффект), имеет обратный порядок стабилизации. Полученные результаты в общих чертах совпадают с этой точкой зрения. Присоединение к нему иона NHj происходит с преимущественным образованием о-аниона ( а не ле-аниона) и, таким образом, приводит к ж-аминоанизолу. [19]
Кислотность ароматических протонов ( фактически определяемая стабильностью образующегося аниона) зависит от индуктивного эффекта заместителей. Поэтому элек-троноакцепторные группы, как, например, ОСН3, стабилизируют анионы орто мета пара, тогда как СН3 - группа, обладающая электронодонорным индуктивным эффектом ( слабый эффект), имеет обратный порядок стабилизации. Полученные результаты в общих чертах совпадают с этой точкой зрения. [20]
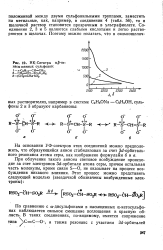 |
ИК-Спектры а ( 5-не-насыщенных сульфонов. [21] |
На основании УФ-спектров этих соединений можно предположить, что образующийся анион стабилизован за счет - орбитального резонанса атома серы, как изображено формулами бив. [22]
Если же эти заместители электроноакцепторные и способствуют стабилизации промежуточно образующегося аниона, то применяются инициаторы анионного типа. [23]
Оно представляет собой сильную кислоту из-за значительной энергии стабилизации образующегося аниона. [24]
В основе сольволитических методов ( 5) лежит способность образующихся анионов диссоциировать с образованием секстетных частиц по S N - меха-ниэму. [25]
По мере уменьшения р йГа кислоты, что эквивалентно увеличению стабильности образующегося аниона и уменьшению эндотермич-ности реакции отрыва протона, величина ( 3 уменьшается, что свидетельствует о сдвиге переходного состояния в сторону исходного и согласуется с постулатом Хэммонда. [26]
Подобные аномалии могут дать важную информацию о механизмах реакций и строении образующихся анионов. Как правило, они проявляются тогда, когда при образовании аниона происходит резкое изменение распределения электронной плотности и, как следствие, значительные изменения в структуре сольвата-ционной сферы. [27]
Если стерические требования к сольватации фенольного и фор-мильного атомов кислорода в образующихся анионах одинаковы, то общая сольватация 4-формилфенолятного и 4-формил - 2 6-ди-грег - бутилфенолятного анионов должна быть примерно одинакова. Это объясняется тем, что, хотя стерический эффект грег-бутильных групп резко уменьшает сольватацию фенолятного кислорода, он одновременно способствует большей делокализации электронной плотности с увеличением ее на атоме кислорода формильной группы, способствуя тем самым дополнительной сольватации этой группы. Следовательно, суммарное изменение в сольватации анионов в целом в этом случае должно быть, по-видимому, весьма мало. [28]
Так, триметилсилилцингерон ( 66) может депротонироваться в условиях кинетического контроля; образующийся анион улавливается гексаналем с образованием триметилсилилового эфира джинджерола ( 67) схема ( 63) [87], едкого начала имбирного корня. Силиловый эфир расщепляется при кратковременной обработке разбавленной кислотой, не затрагивающей чувствительного звена р-кетола. [29]
 |
Изменение кислотного числа эфиров в процессе гидролиза при ЮО С. [30] |
Страницы: 1 2 3 4