Восстановление - радикал
Cтраница 2
Образовавшийся анион-радикал, отщепив протон от подходящего донора, превращается в радикал. Восстановление радикала из-за значительного сродства его к электронам, избыток которых присутствует в реакционной среде, проходит быстро и необратимо. Димеризация радикалов редко осложняет процесс восстановления. Возникший анион основен и, присоединяя протон от внесенного в реакционную среду донора протонов, дает конечный продукт - несопряженный дигидробензол. [16]
Это соединение представляет собой красноватую жидкость, перегоняющуюся без разложения и устойчивую к. Восстановление радикала приводит к образованию N-ди-грег - бутилгидроксиламина, который при окислении воздухом быстро вновь превращается в радикал. [17]
Процесс электровосстановления нитроксильных радикалов существенно зависит от материала катода. Отмечается, что восстановление радикалов 2 и 8 на платине затруднено по сравнению с восстановлением на стеклографите. [18]
При высоких скоростях развертки потенциала с реакцией отщепления протона начинает конкурировать гетерогенный процесс восстановления радикала - RH, н на циклической вольт-амперограмме появляется обратный пик. Экспериментально определенные потенциалы восстановления радикала - RH находятся в хорошем соответствии с потенциалами, предсказанными на основании корреляции между Е и энергией орбитали, рассчитанной методом МОХ, если предполагать, что протонирование дианиона происходит по положению, для которого расчет методом МОХ дает наибольшую плотность заряда. Восстановление радикалов - RH, образующихся из альтернантных углеводородов, всегда протекает соучастием несвязывающей молекулярной орбитали, а экспериментальные значения потенциала, при котором происходит их восстановление, близки к - 1 1 В ( отн. [19]
Если кислотами являются и окисленная, и восстановленная формы системы, то на графике Е /, - рН вблизи каждого значения рК наблюдаются изломы, причем, если после излома абсолютная величина Д - Е / АрН повышается, то данный излом обусловлен диссоциацией окисленной формы, если понижается - то излом обусловлен диссоциацией восстановленной формы. Следует отметить, что восстановление N-окисных радикалов осложнено кинетическими факторами [478], проявляющимися вследствие неполной обратимости электрохимической стадии. [20]
Если кислотами являются и окисленная, и восстановленная формы системы, то на графике JSi /, - рН вблизи каждого значения рК наблюдаются изломы, причем, если после излома абсолютная величина Д - йд / ДрН повышается, то данный излом обусловлен диссоциацией окисленной формы, если понижается - то излом обусловлен диссоциацией восстановленной формы. Следует отметить, что восстановление N-окисных радикалов осложнено кинетическими факторами [478], проявляющимися вследствие неполной обратимости электрохимической стадии. [21]
Иное положение в щелочной среде, где область потенциалов может быть гораздо шире. Из теории известно, что при рН8 восстановление радикала, образовавшегося после переноса первого электрона на молекулу ацетофенона, заторможено в довольно широком интервале потенциалов. Это торможение обусловлено конкурирующей химической реакцией диссоциации спиртового радикала с образованием аниона RR CO -, который в сильнощелочной среде почти не протонируется. [22]
Получение оксиаминопиперидина 6 по этому способу проходит в две стадии, первой из которых является взаимодействие кетон-радикала с гидразин-гидратом. В результате этой реакции образуется соответствующий гидразон и происходит восстановление радикала до соответствующего гидроксиламина 13, который и является реагирующей частицей при электролизе. [23]
В работах [334, 335] исследовано электрохимическое восстановление нитроксилов в неводных средах. Показано, что растворители, являющиеся донорами протонов, облегчают восстановление радикалов. [24]
Пространственные затруднения, отчасти обусловливающие высокую стабильность иминоксилов, в меньшей мере отражаются на реакционной способности гидроксиламинов. С хлорангидридами карбоновых кислот, арилсульфохлоридами и фенилизоцианатом замещенные гидроксиламины образуют хорошо кристаллизующиеся производные, которые были использованы для установления структуры и идентификации продуктов восстановления иминок-сильных радикалов. [25]
Другой способ разделения спектров в гетерогенной системе состоит во введении в одну из ее областей химических реагентов, восстанавливающих радикальный фрагмент. Если восстановитель ( например, аскорбиновая кислота, как в работе [129], или ферро-цианид калия, как в работе [130]) локализован лишь в одной области системы и радикал не перераспределяется между областями, либо перераспределяется достаточно медленно, то восстановление радикалов приведет к исчезновению лишь одного из простых спектров. [26]
При высоких скоростях развертки потенциала с реакцией отщепления протона начинает конкурировать гетерогенный процесс восстановления радикала - RH, н на циклической вольт-амперограмме появляется обратный пик. Экспериментально определенные потенциалы восстановления радикала - RH находятся в хорошем соответствии с потенциалами, предсказанными на основании корреляции между Е и энергией орбитали, рассчитанной методом МОХ, если предполагать, что протонирование дианиона происходит по положению, для которого расчет методом МОХ дает наибольшую плотность заряда. Восстановление радикалов - RH, образующихся из альтернантных углеводородов, всегда протекает соучастием несвязывающей молекулярной орбитали, а экспериментальные значения потенциала, при котором происходит их восстановление, близки к - 1 1 В ( отн. [27]
Таким образом, при потенциалах второй волны наблюдается конкуренция двух процессов, приводящих к гибели свободных радикалов: их димеризация и их дальнейшее восстановление. Эта конкуренция обусловливает характерные особенности второй волны. Электрохимическая стадия процесса восстановления радикалов необратима, рН раствора на нее не влияет. [28]
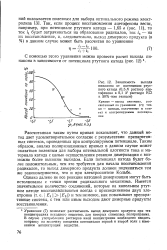 |
Зависимость выхода пинакона от потенциала ртутного катода ( 0 5 N раствор ацетофенона в 0 1 Л растворе КС1 в 50 % - ном этаноле. [29] |
Рассчитанная таким путем кривая показывает, что данный метод дает удовлетворительное согласие с результатами препаративных синтезов, проведенных при контролируемом потенциале. Таким образом, анализ поляризационных кривых в данном случае может оказаться полезным для выбора оптимальной плотности тока и материала катода с целью осуществления реакции димеризации с возможно более высоким выходом. Если потенциал катода будет более положительным, чем это требуется для начала восстановления радикалов, то выход димерного продукта должен подчиняться тем же закономерностям, что и при электросинтезе Кольбе. [30]
Страницы: 1 2 3