Активность - ион - водород
Cтраница 2
Активности ионов водорода и показатели активностей ионов водорода вычисляют по формулам, в которые входят истинные константы; значение этих констант не изменяется в зависимости от величины ионной силы раствора ( см. Книга I, Качественный анализ, гл. Для удобства пользования эти формулы сведены в общуютабл. [16]
Активность ионов водорода в фосфорной кислоте, содержащей 45 % Р205 и различное количество H2SiF6 и HF, возрастает по сравнению с кислотой, в которой отсутствует фтор. Так, при увеличении концентрации фтора в виде H2SiF6 и HF от 0 до 4 % активность ионов водорода возрастает соответственно в2и 1.2 раза. Однако это не приводит к росту степени разложения фосфорита. [17]
Активность ионов водорода в магнийфосфатных растворах, позволяющих извлекать магний из фосфорита без разложения фосфатной части сырья ( 7р 0), изменяется с 0 0794 г-ион / л для раствора состава: 10 % Р2О5 и 0 9 % MgO до 2 512 г-ион / л при содержании в растворе 40 % Р2О5 и 6 % MgO. Это объясняется, видимо, тем, что выделяющийся в процессе растворения карбонатных соединений СО2 препятствует осаждению фосфатных пленок на зернах доломита и кальцита. В результате этого происходит локальное осаждение фосфатов кальция лишь на фосфатных зернах фосфорита. [18]
Активность ионов водорода в прикатодном слое в этом случае будет определяться активностью щелочи в нем. [19]
Активность ионов водорода и рН буферных смесей могут быть рассчитаны из уравнения константы диссоциации слабой кислоты. [20]
Активность ионов водорода, а следовательно, и рН могут быть определены различными методами ( колориметрическим, кинетическим и электрометрическим); из них наиболее разработанным и точным является электрометрический, основанный на определении величины электродного потенциала. [21]
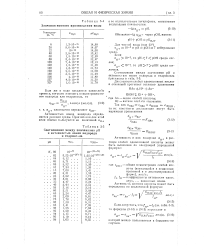 |
Значения ионного произведения воды. [22] |
Активностью ионов водорода определяется реакция среды. [23]
Поскольку активность ионов водорода в стандартном растворе равна единице, относительная активность 2Н оказывается численно равной активности ионов водорода в данном растворе и, следовательно, для расчета рН ее можно логарифмировать. Молярная концентрация в стандартном растворе также равна единице, поэтому относительная концентрация в данном растворе совпадает с молярной концентрацией и для приближенного расчета рН в растворах невысоких концентраций можно брать логарифм этой величины. Эту оговорку всегда следует иметь в виду, когда производится логарифмирование. [24]
Однако активность ионов водорода измерить непосредственно нельзя, так как невозможно ввести в раствор ионы только одного заряда без того, чтобы в то же самое время не ввести в раствор ионы с противоположным по знаку зарядом. [25]
Поскольку активность ионов водорода в стандартном растворе равна единице, относительная активность ан оказывается численно равной активности ионов водорода в данном растворе и, следовательно, для расчета рН ее можно логарифмировать. Молярная концентрация в стандартном растворе также равна единице, поэтому относительная концентрация в данном растворе совпадает с молярной концентрацией и для приближенного расчета рН в растворах невысоких концентраций можно брать логарифм этой величины. Эту оговорку всегда следует иметь в виду, когда производится логарифмирование. [26]
Если активность ионов водорода равна единице ан 1 ( принимается, что это выполняется, когда концентрация ионов Н равна 1 моль / л) и парциальное давление водорода, равное атмосферному, условно принято равным единице, то из приведенного уравнения следует, что ЕН2Ен2 - Именно такой электрод, работающий при 25 С ( 298 К), и называется стандартным, а его потенциал условно принимается равным нулю. [27]
Уменьшение активности ионов водорода делает потенциал более отрицательным. Так же влияет увеличение парциального давления газа водорода. [28]
Повышение активности ионов водорода приводит соответственно к понижению активности ионов гидроксила, так как произведение этих активностей должно быть постоянной величиной при данной температуре. Чтобы упростить вычисления, часто не учитывают коэффициенты активности. Для разбавленных растворов вводимая при этом погрешность не очень велика. [29]
Уменьшение активности ионов водорода делает потенциал более отрицательным. Так же влияет увеличение парциального давления газа водорода. [30]
Страницы: 1 2 3 4