Активность - ион - водород
Cтраница 3
Измерение активности ионов водорода обоих растворов показывает, что она резко различна. [31]
К включает активность ионов водорода ( aH) i внутри шарика стеклянного электрода. [32]
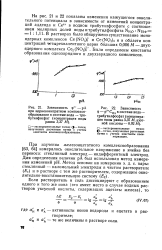 |
Зависимость q - рА при цериевонитратном комплексе-образовании в системе вода - три-бутилфосфат ( концентрация воды равна 3 37 М. [33] |
А - активности ионов водорода и ацетата в растворителе; ан и ал - те же величины в растворе соли. [34]
При повышении активности иона водорода электродвижущая сила элемента уменьшается. [35]
Для определения активности ионов водорода 0 используются гальванические элементы, составленные из двух электродов т - индикаторного, потенциал которого зависит от GJJ и электрода сравнения с устойчивым хорошо известным потенциалом. [36]
Величина рН определяет активность ионов водорода в растворе, а не содержание кислоты или щелочи. Это подтверждается тем обстоятельством, что в химически нейтральной воде с увеличением температуры воды величина рН уменьшается, потому что в нагретой воде увеличивается число диссоциирующих молекул и возрастает концентрация ионов водорода. [37]
По определению, активность ионов водорода н стандартного водородного потенциала также равна единице. [38]
Результаты потенцяометрических измерений активности ионов водорода ( ан) в ряде растворов плавиковой кислоты приведены ниже. [39]
При потенциометрическом определении активности ионов водорода ан и рН среды используются электроды, потенциал которых зависит от ан раствора электролита. Удобными и часто используемыми электродами являются водородный, хингидронный и стеклянный электроды. Кроме указанных, используется также ряд других электродов. [40]
Наряду с определением активности ионов водорода и рН по-тенциометрический метод широко применяется и для определения общей концентрации той или другой кислоты ( или основания) под названием потенциометрического титрования. Сущность потенцио-метрического титрования заключается в том, что при титровании измеряется потенциал электрода, погруженного в титруемый раствор. Потенциал электрода меняется ло мере титрования, причем в эквивалентной точке происходит резкое его изменение. Ход процесса существенно зависит от силы кислоты и основания, применяемых в опыте. [41]
Водородный электрод с активностью ионов водорода, равной 1, и давлением газообразного водорода, равным 1 013 - 10 Па; потенциал такого электрода условно принят равным нулю при любой температуре. [42]
ОН -) - активности ионов водорода и гидроксид-ионов соответственно, а активность воды принята равной единице. [43]
Таким образом, когда активность иона водорода или его концентрация равна константе индикатора, индикатор сбстоит из равных количеств диссоциированной и недиссоциированной форм и, следовательно, имеет в точности свою промежуточную окраску. [44]
Это означает, что активность ионов водорода больше единицы. [45]
Страницы: 1 2 3 4