Активность - отдельный ион
Cтраница 1
Активность отдельного иона нельзя точно определить по уравнению Нернста в силу неопределенности потенциала данного электрода. [1]
Активность отдельного иона выражается в виде произведения концентрации иона на коэффициент активности. [2]
Поскольку активности отдельных ионов неизвестны, то и точный расчет Афдифф по формуле ( VI. Однако если в разбавленных растворах активности отдельных ионов в первом приближении заменить их концентрациями, то, задавшись определенным распределением концентраций в области между двумя растворами, величину Дсрдифф можно рассчитать с погрешностью, которая будет тем меньше, чем более разбавленные растворы находятся в контакте друг с другом. [3]
Поскольку активности отдельных ионов неизвестны, то и точный расчет Афдифф по формуле (VI.27) невозможен. Однако если в разбавленных растворах активности отдельных ионов в первом приближении заменить их концентрациями, то, задавшись определенным распределением концертраций в области между двумя растворами, Афдифф можно рассчитать с погрешностью, которая будет тем меньше, чем более разбавленные растворы находятся в контакте друг с другом. [4]
Поскольку активности отдельных ионов неизвестны, то ан осг где а - средняя активность соляной кислоты. [5]
Коэффициенты активности отдельных ионов, рассчитанные с помощью соотношений ( V. [6]
Связь активностей отдельных ионов с активностью растворяемой соли устанавливается исходя из условия электронейтральности. [7]
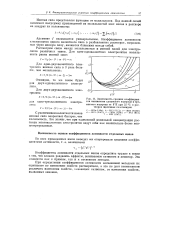 |
Зависимость средних коэффициентов активности хлористого водорода и бромистого водорода от Ym при 25 С в растворах щелочных галогенидов. [8] |
Коэффициенты активности отдельных ионов определить трудно в связи с тем, что сложно разделить эффекты, вызываемые катионом и анионом. Это относится как к прямым, так и к косвенным методам. [9]
Коэффициенты активностей отдельных ионов меняются в зависимости от ионной силы раствора ( /), связанной с величиной заряда ионов и концентрацией электролита. [10]
Коэффициенты активности отдельных ионов определить трудно в связи с тем, что сложно разделить эффекты, вызываемые катионом и анионом. Это относится как к прямым, так и к косвенным методам. [11]
Коэффициенты активности отдельных ионов нельзя определить опытным путем, но они могут быть вычислены при некоторых допущениях на основании теории сильных электролитов. Согласно этой теории, коэффициент активности / представляет собой меру влияния междуионных сил на способность иона к химическим взаимодействиям. [12]
Коэффициенты активности отдельных ионов не могут быть жспериментально определены. [13]
Коэффициенты активности отдельных ионов зависят от состава раствора, а именно, от вызванной всем имеющимся ионом ионной силы / м - - тг, где т - молярность, a z - валентность отдельных ионов. В табл. 2 приведены значения этих величин, расчитанные из экспериментально найденных значений растворимостей и соответствующих составов растворов. Коэффициенты активности отдельных ионов, соответствующие вычисленным ионным силам растворов, взяты из Льюиса и Рендела [3] или, если это было необходимо, экстраполированы. [14]
Коэффициенты активности отдельных ионов зависят от состава раствора, от ионной силы и, поэтому коэффициент активности находящегося при большом разведении иона Ra, так же как и коэффициент активности иона SO, уменьшается при увеличении общей концентрации раствора. Коэффициенты активности отдельных ионов взяты из сводной таблицы Льюиса и Рендел [4], причем для радия взяты коэффициенты, приведенные для двухвалентного иона. Na SO4 коэффициенты получены экстраполяцией, что можно сделать графическим методом с большой точностью, так как между ] / /, и gy существует почти прямая пропорциональность. Произведение растворимости, напротив, увеличивается почти в 4 раза. [15]
Страницы: 1 2 3 4