Активность - отдельный ион
Cтраница 2
Так как активности отдельных ионов часто неизвестны, при расчете используют средние значения активностей а и коэффициентов активности у ионов данного электролита. [16]
Хотя коэффициенты активности отдельных ионов, например ТА и ТЕ - т чно не определяются, тем не менее их отношение для одной фазы, скажем Тв / Тд определить можно; соответствующее термодинамическое уравнение можно вывести стро го - см. ниже. [17]
Хотя коэффициенты активности отдельных ионов, например ТА и fB точно не определяются, тем не менее их отношение для одной фазы, скажем 7В / 7А, определить можно; соответствующее термодинамическое уравнение можно вывести строго - см. ниже. [18]
Поскольку коэффициенты активности отдельных ионов термодинамически неопределимы, часто вместо них используют средние коэффициенты активности электролита в целом. [19]
Вычисление коэффициентов активности отдельных ионов можно было бы произвести по коэффициенту активности соли, если известен коэффициент активности второго иона. Тогда, предполагая, что коэффициент активности отдельного иона зависит лишь от ионной силы раствора, можно, переходя от одного электролита к другому ( с общим ионом), вычислить коэффициенты активности отдельных ионов. Такой расчет, в силу некоторой произвольности исходных данных и невозможности распространения правила ионной силы на любые концентрации, не может дать точных результатов, хотя для практических целей весьма удобно считать коэффициенты активности ионов одинаковой валентности приблизительно равнцми, если одинаковы ионные силы растворов. [20]
Невозможность определения активности отдельных ионов является частью проблемы установления абсолютного нуля потенциала. [21]
Для вычисления активностей отдельных ионов необходимо сделать дополнительное допущение. [22]
Невозможность определения активности отдельных ионов является частью проблемы установления абсолютного нуля потенциала. Если бы были известны значения потенциалов отдельных электродов, то определение активности отдельных ионов оказалось бы возможным. Теория электродных потенциалов, развиваемая А. Н. Фрумкиным, вероятно, даст в дальнейшем такую возможность. [23]
Вычисление коэффициентов активности отдельных ионов можно было бы произвести по коэффициенту активности соли, если известен коэффициент активности второго иона. Тогда, предполагая, что коэффициент активности отдельного иона зависит лишь от ионной силы раствора, можно, переходя от одного электролита к другому ( с общим ионом), вычислить коэффициенты активности отдельных ионов. [24]
Поскольку коэффициенты активности отдельных ионов термодинамически неопределимы, то часто вместо них используют средние коэффициенты активности электролита в целом. [25]
Для вычисления активностей отдельных ионов необходимо сделать дополнительное допущение. [26]
Невозможность определения активности отдельных ионов является частью проблемы установления абсолютного нуля потенциала. Если бы были известны значения потенциалов отдельных электродов, то определение активности отдельных ионов оказалось бы возможным. Теория электродных потенциалов, развиваемая А. Н. Фрумкиным, вероятно, даст в дальнейшем такую возможность. [27]
Определить коэффициенты активности отдельных ионов из опытных данных невозможно. В связи с этим пользуются средней активностью электролита, представляющей собой среднее геометрическое из активностей ионов, составляющих данный электролит. [28]
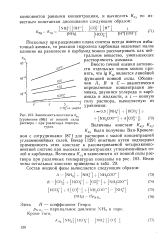 |
Зависимость константы k [ уравнение ( 68 ]. [29] |
Вместо точной оценки активности отдельных ионов можно принять, что lg Кщ является линейной функцией ионной силы. [30]
Страницы: 1 2 3 4