Активность - электрод
Cтраница 2
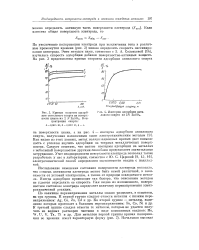 |
Кривые скорости адсорбции октилового спирта па поверхности цинка аз 2 N ZnS04. Концентрация спирта. [16] |
Исследование изменения состояния поверхности электрода показало, что степень активности электрода может быть самой различной, в зависимости от условий электролиза, а также от природы осаждаемого металла. Иногда адсорбция происходит так быстро, что описанным методом не удается определить ее скорость. Как видно из изложенного, поверхностное состояние электрода определяет величину перенапряжения электрохимической реакции. [17]
Если реагент способен растворять выделенный на электроде радиоактивный элемент, то активность электрода во времени будет уменьшаться. [18]
Уравнение ( 171) дает возможность рассчитать ток обмена по двум измерениям активности электрода в том случае, если в на - чальный момент он не содержал на поверхности меченых ионов. [19]
Карбонизация приводит к снижению электрической проводимости электролита, а также к ухудшению активности электродов в основном из-за кристаллизации карбоната на поверхности и в порах. Поэтому при использовании углеродсодержащего топлива рекомендуется применять в качестве электролитов ТЭ растворы кислоты. Наиболее высокой электрической проводимостью обладают растворы азотной, соляной и серной кислот. Однако азотная и соляная кислоты в ТЭ не устойчивы, поэтому в качестве электролита применяют растворы серной кислоты, а при 100 С и выше также растворы фосфорной кислоты. Электрическая проводимость зависит от концентрации раствора электролита. Кривая зависимости удельной электрической проводимости от концентрации электролита проходит через максимум. Положение максимума несколько сдвигается в сторону более высоких концентраций при увеличении температуры. Электрическая проводимость электролитов возрастает с увеличением температуры. [20]
Некоторые реакции анодного окисления хорошо идут только на чистой поверхности платины, и активность электрода быстро падает вследствие образования поверхностных окислов. [21]
Активность цинковых электродов, изготовленных посредством электролиза импульсным током с большой скважностью значительно превышает активность электродов, приготовленных двумя другими способами. Наименьшей активностью, как и следовало ожидать, обладают электроды, изготовленные непосредственно из перфорированной цинковой фольги. [22]
Активность цинковых электродов, изготовленных способом электролиза импульсным током с большой скважностью значительно превышает активность электродов, приготовленных двумя другими способами. Наименьшей активностью, как и следовало ожидать, обладают электроды, изготовленные непосредственно из перфорированной цинковой фольги. [23]
Так, Фокин [30] при электровосстановлении олеиновой кислоты на никелевом катоде наблюдал постепенное снижение активности электрода. [24]
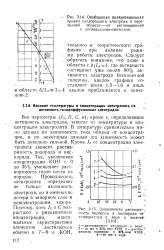 |
Обобщенная поляризационная кривая кислородного электрода в переходной области - от активационной к активацнонно-омической.| Зависимости раствори -.. [25] |
Все параметры ( / 0, D, С, о), кроме s, определяющие активность электродов, зависят от температуры и концентрации электролита. В литературе сравнительно мало данных по зависимости тока обмена от концентрации, и по некоторым данным эта зависимость может быть довольно сильной. [26]
В результате электрохимических процессов в ТЭ образуются продукты реакции, которые могут изменять состав электролита, влиять на активность электродов, разбавлять реагенты в электродных камерах. Для обеспечения стабильной работы элемента необходима непрерывная система отвода реагентов, которая может включать систему контроля состава электролита или характеристик элементов, на которые влияют продукты реакции. Система отвода продуктов реакции может изменяться в зависимости от типа элементов и вида продуктов реакции. [27]
 |
Прибор Жолио-Кюри. [28] |
Следует отметить, что метод определения критического потенциала выделения по кривой типа, представленного на рис. 214, полученной измерением активности электрода при постепенном изменении его потенциала, дает не всегда точные значения критического потенциала. По этому методу снимается кривая, дающая значения не только скоростей выделения изучаемого элемента при достаточно отрицательном потенциале, но и скоростей растворения его при понижении катодной поляризации электрода ниже значения равновесного потенциала. [29]
 |
Кривая выделения-растворения, полученная по методу Зива. [30] |
Страницы: 1 2 3 4