Относительная каталитическая активность
Cтраница 3
Перечисленные свойства этого катализатора обуславливают все более широкое использование его для промышленного осуществления реакции оксиэтилирования различных спиртов. Вместе с тем в литературе отсутствуют данные по относительной каталитической активности эфирата фтористого бора в реакциях с различными спиртами в сопоставимых условиях, что затрудняет оценку перспективы его использования в различных синтезах. [31]
Перечисленные свойства этого катализатора обуславливают все более широкое использование его для промышленного осуществления реакции оксиэтилирования различных. Вместе с тем в литературе отсутствуют данные по относительной каталитической активности эфирата фтористого бора в реакциях с различными спиртами в сопоставимых условиях, что затрудняет оценку перспективы его использования в различных синтезах. [32]
Сопоставление каталитической активности с qs использовано для суждения об однотипности катализаторов окислительных реакций. Показано существенное ограничение принципа энергетического соответствия: возможность предсказания с его помощью лишь относительной каталитической активности в рядах однотипных контактов. Термодинамический метод применен также для оценки относительной реакционной способности различных молекул при их окислении на данном катализаторе. [33]
Корреляционные зависимости между каталитической активностью и qs использованы для суждения об однотипности металлов и окислов как катализаторов окисления. Показано принципиальное ограничение правила энергетического соответствия: возможность предсказания с его помощью лишь относительной каталитической активности в рядах однотипных катализаторов данной реакции. [34]
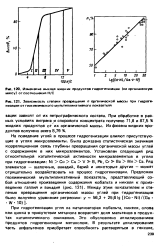
Изучена относительная каталитическая активность эфирата фтористого бора в сопоставимых условиях в реакции окиси этилена с метиловым, этиловым и бутиловым спиртами, гептанолом-4, деканолом-5, октанолом-2 и бутилцеллозольвом в температурном интервале 30 - 60 С. Для всех спиртов вычислены значения энергии активации и предэкспоненциалыгого множителя, которые оказались связанными удовлетворительной корреляционной зависимостью. Предложено уравнение, связывающее кон-етанту скорости с энергией активации. Определена изокинетическая температура и соответствующая ей константа скорости второго порядка. [35]
Изучена относительная каталитическая активность эфирата фтористого бора в сопоставимых условиях в реакции окиси этилена с метиловым, этиловым и бутиловым спиртами, гептанолом-4, деканолом-5, октанолом-2 и бутилцеллозольвом в температурном интервале 30 - 60 С. Для всех спиртов вычислены значения энергии активации и предэкспоненциального множителя, которые оказались связанными удовлетворительной корреляционной зависимостью. Предложено уравнение, связывающее константу скорости с энергией активации. Определена изокинетическая температура и соответствующая ей константа скорости второго порядка. [36]
На поведение углей в процессе гидрогенизации влияют присутствующие в углях микроэлементы. Была доказана статистическая значимая корреляционная связь глубины превращения органической массы углей с содержанием в них микроэлементов. Установлен следующий ряд относительной каталитической активности микроэлементов в углях при гидрогенизации: Ni Со Си V В, РЬ, Сг Ва Мп Са. Ряд элементов - щелочные, ванадий, барий и некоторые другие - может отрицательно воздействовать на процесс гидрогенизации. [38]
Теория кристаллического поля удобна для химиков, так как она связывает каталитическую активность непосредственно с химическими свойствами катализаторов. Эта теория удовлетворительно объясняет сходство закономерностей изменения каталитической активности соединений переходных металлов, наблюдавшееся в ряде случаев в гомогенном и гетерогенном катализах. Например, в окислительно-восстановительных реакциях в растворах относительные каталитические активности ионов Со2 / Со3, Ni2 / Ni3 и Мн2 / Мп3 приблизительно такие же, как и в реакции окисления С2Н4 на твердых окислах Со, Ni и Мп. Ионы Мп2 и Fe3, свободные или в составе комплексов, ведут себя обычно так же, как ионы непереходных металлов. [39]
В последнее время удалось до некоторой степени выяснить, почему в ряду благородных металлов серебро обладает исключительными каталитическими свойствами при окислении этилена. В соответствии с перекисной теорией система металл - катализатор может образовывать супероксид, а при окислении этилена в окись этилена необходимо образование промежуточной перекиси этилена, что требует разрушения этого супероксида. Если предположить, что такие благородные металлы, как платина, золото и палладий, действуют в качестве катализаторов окисления этилена по одинаковому механизму, то их относительная каталитическая активность должна определяться прочностью связи металл - молекулярный кислород. [40]
Связь адсорбционных свойств с каталитической активностью, с одной стороны, и стабильностью я-комплексов, с другой, означает также и зависимость каталитической активности от стабильности образующихся я-комплексов. На рис. 8 в логарифмических координатах отложены величины относительной каталитической активности кобальта, никеля и родия в реакции гидрирования алкилароматических соединений в газовой фазе, а также, по данным [17], для родия в жидкой фазе. На оси абсцисс нанесена стабильность соответствующих я-комплексов. На этом графике величины kr выражают относительную каталитическую активность по сравнению с активностью в реакции гидрирования толуола, принятой за единицу. [41]
Первое, на что обратил внимание Оствальд - это то, что скорость реакций представляет величину измеримую. Следовательно, все то, что оказывает на реакции влияние, так или иначе отразится на скорости. Вносимые в реакционную среду посторонние вещества или ускоряют, или замедляют реакции. Таким образом, измерение скорости позволяет количественно определять относительную каталитическую активность различных веществ или разных концентраций одного и того же вещества. Теперь известно, какое большое значение в исследовании каталитических явлений имеет это положение Оствальда. [42]
Для спиртов, начиная от этилового, адсор-бция с температурой уменьшается резче, чем для метанола, что объясняется тем, что уже при 100 - 150 в адсорбционном слое происходит дегидратация спирта, причем олефин десорбируется, а на катализаторе остается вода, молекулярный вес которой значительно меньше, чем молекулярный вес спирта. Это согласуется с изломом на кривых, адсорбции зо - СзН7ОН при 240 - 270, когда начинается заметное оле-финообразование. Из приведенных данных видно, что при температурах, когда реакция дегидратации идет с заметной скоростью, адоорбционно. Это может быть одной из причин часто наблюдаемого несоответствия между величинами удельной поверхности и относительной каталитической активностью катализаторов. [43]
Страницы: 1 2 3