Актиномицин
Cтраница 2
Связывание актиномицина и АК идет ступенчато, через ряд промежуточных форм. Комплексообразование меняет конформа-дию ДНК. В такой ДНК основная правая спираль закручена в правую спираль более высокого порядка. Раскручивание сверхскрученной ДНК при образовании комплекса приводит вследствие топологических особенностей кольцевой структуры самой ДНК к изменениям геометрии всей макромолекулы. Установлено существование критической концентрации лиганда, отвечающей полному раскручиванию сверхспирали; дальнейшее добавление красителя вызывает закручивание ДНК в обратном направлении с образованием левой сверхспирали. Эти факты обнаруживаются методом седиментации. [16]
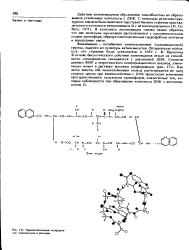 |
Предпочтительная конфирмации эхиномицина в растворе. [17] |
Действие актиномицинов обусловлено способностью их образовывать устойчивые комплексы с ДНК. В комплексе актиномицин связан таким образом, что две молекулы иуклеозида располагаются с противоположных сторон хромофора, образуя многочисленные гидрофобные контакты и водородные связи. [18]
Молекула актиномицина D ( актиномицина С1) содержит плоский феноксазоновый хромофор, несущий две карбоксильные группы. Обе эти группы соединены с одинаковыми циклическими пептидами, состоящими из остатков L-треонина, D-валина, L-пролина, саркозина ( N-метилглици на) и L-ме-тилвалина. [19]
Так, актиномицин подавляет образование информационной РНК на матрице ДНК - клетка не получает соответствующего плана и синтез белка не идет. Тетрациклины препятствуют присоединению транспортных РНК к соответствующему месту полисомы. Сходным образом действует хлорамфени-кол - он избирательно действует на 505-субъединицы рибосом, нарушая реакции, предшествующие построению на рибосоме полипептидной цепи. [20]
Все эти актиномицины биологически активны, они проверены на 12 тест-организмах. [21]
В присутствии актиномицина D ( 10 мкг / мл) был получен иной эффект. [22]
С химической стороны актиномицин А изучен очень мало, хотя в литературе и имеется несколько высказываний относительно строения его молекулы 6 1М9, которые, впрочем, нельзя считать сколько-нибудь обоснованными. [23]
Своеобразными хромопептидами являются актиномицины. Наличие у них одновременно пептидных и сложноэфирных связей позволяет относить их к депсипеитидам. Первый представитель этого типа антибиотиков ( актиномицин А) был найден еще в 1940 г., причем вскоре было обнаружено, что вследствие высокой токсичности О Н с может найти практического применения в качестве антибактериального средства. Вскоре было открыто еще несколько аналогичных антибиотиков, названных актино-мицина мп В и С, причем вначале они также не нашли применения. Было выяснено, что ранее выделенные актиномици-лы представляют собой сложные смеси сходных веществ, разделение которых удалось осуществить с помощью противоточнаго распределения и распределительной хроматографии. Актиномицины находят небольшое применение для лечения лимфогрануломатоза, некоторых опухолей лимфатической системы и других органов, но до настоящего времени еще имеются очень противоречивые оценки их практической ценности. [24]
РНК - Действие актиномицина Д было направлено главным образом на снижение синтеза РНК в рибосомах. Пуромицин и 8-азагуанин почти вдвое сильнее ингибировали включение лейцина - С14 в белки, но активирующее действие ауксина в значительной степени сохранялось. Во вновь синтезированной РНК 70 % активности было связано с АМФ и 30 % - с ГМФ. [25]
Формула одного из актиномицинов ( актиномицина С3) приведена выше. Недавно осуществлен его полный синтез. Различие между отдельными актиномицинами зависит, как уже упоминалось, от строения или взаимного расположения аминокислот, входящих в состав двух его циклопептидных частей, где вместо одного или двух остатков пролина могут находиться остатки окси-пролина или у ксопролина, а вместо остатков изолейцина - остатки валина или других аминокислот. [26]
Первый полный синтез актиномицина С3 осуществлен путем циклизации по амидной связи. [27]
Изучение аминокислотного состава актиномицинов, входящих в состав аурантина, показало: в Ayi входят по два остатка треонина, изо-лейцина, пролина, саркозина и N-метилвалина. В Ау2 - те же аминокислоты и валин. В Ау3 отсутствует изолейцин, в Ау4 присутствуют все шесть аминокислот. Описанные актиномицины различаются между собой лишь по содержанию валина и изолейцина. [28]
Более высокая концентрация актиномицина подавляет также репликацию ДНК. Из того что актиноми-цины в противоположность пенициллинам не имеют принципиального различия в действии на бактериальные клетки и клетки инфицированного организма-хозяина, неизбежно следует высокая токсичность этих пептидных антибиотиков. Цитостати-ческую активность актиномицинов используют при исследованиях в области клеточной биологии. [29]
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ин-гибирует транскрипцию ДНК. [30]
Страницы: 1 2 3 4