Роданидный комплекс - железо
Cтраница 2
Растворы солей никеля и роданидного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплекса железа велико, а светопоглощение соли никеля незначительно. [16]
Поэтому интенсивность окраски раствора роданидного комплекса железа в присутствии ионов фтора уменьшается. [17]
Растворы солей никеля и роданидного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплексом железа велико, а светопоглощение раствором соли никеля незначительно. [18]
Растворы солей никеля и роданидного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплекса железа велико, а светопоглощение соли никеля незначительно. [19]
Растворы солей никеля и роданидного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплексом железа велико, а светопоглощение раствором соли никеля незначительно. [20]
Как показывают константы нестойкости, роданидные комплексы железа малоустойчивы и их образование зависит от концентрации избытка роданид-ионов. [21]
Ниже приводятся величины констант нестойкости роданидных комплексов железа - имеющих большое значение в аналитической химии. [22]
Ниже приводятся величины констант нестойкости роданидных комплексов железа, имеющих большое значение в аналитической химии. [23]
Применяют изоамиловый спирт для экстракции роданидных комплексов железа; при фотометрическом определении ванадия 8-оксихинолином, молибдена - фенилгидразином, меди - диэтил-дитиокарбаминатом; для отделения L1C1 от других хлоридов щелочных металлов, извлечения нитрата кальция из смеси с нитратом стронция. [24]
По-следующее количественное определение основано на колоримет-рировании роданидных комплексов железа. [25]
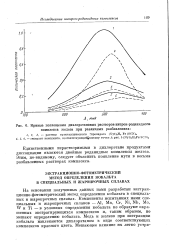 |
Кривые поглощения дихлорэтановых растворов нитрон-роданидного комплекса железа при различных разбавлениях. [26] |
Единственными нерастворимыми в дихлорэтане продуктами диссоциации являются двойные роданидные комплексы железа. Этим, по-видимому, следует объяснить появление мути в весьма разбавленных растворах комплекса. [27]
Так, были определены константы электролитической диссоциации роданидных комплексов железа, имеющих большое значение в аналитической химии. [28]
Таким образом, соотношение концентраций гидроксоком-плексов и роданидных комплексов железа должно резко возрастать в интервале рН б - 8, и в этом интервале рН следует ожидать резкого изменения характера явлений сорбции примеси железа. [29]
Однако Малютина и Орлова [54] показали, что роданидный комплекс железа ( III) можно получить в органической фазе, если вначале экстрагировать железо ( III) из 6 - 8 М раствора хлороводородной кислоты в кислородсодержащий растворитель. Основным требованием к этому варианту метода является достаточно высокая диэлектрическая проницаемость органической фазы. Поэтому рекомендуется после экстракции железа из хлоридного раствора амилацетатом ( е 4 75) разбавить экстракт метилизобутилкетоном ( е 13 11) и после этого ввести в систему роданид-ионы. Метод при этом теряет в чувствительности, но резко возрастает его селективность. Осложняет выполнение анализа высокая кислотность водного раствора. Подбором концентрации хлорид-иона в системе удается экстрагировать железо из основы, образующей экстрагируемые хлоридные комплексы, например из солей кобальта, кадмия, титана, ниобия и др. Осложнения вызывают только основы, образующие плохо растворимые хлориды - свинец, серебро, таллий и некоторые другие элементы, например золото. [30]
Страницы: 1 2 3 4