Кислотность - фенол
Cтраница 1
Кислотность фенола значительно возрастает при наличии в орто - и пара-положениях бензольного кольца сильных электроотрицательных заместителей. Это особенно ярко видно на примере нитрофенолов. Введенная в ароматическое кольцо нит-рогруппа дополнительно стабилизирует феноксид-анион, для которого в данном случае можно написать еще одну каноническую структуру. [1]
Кислотность фенолов возрастает в значительной степени при наличии в молекуле электроноакцепторных групп вследствие индуктивного влияния в любом положении и мезомерного эффекта в орто-и пара-положениях. Накопление электроноакцепторных групп значительно усиливает кислотность. Так, 2 4 6-трини-трофенол ( пикриновая кислота) является сильной кислотой. [2]
Кислотность фенола зависит не только от наличия электроно акцепторных или электронодонорных групп, но и от того, находятс. [3]
Кислотность фенолов зависит от характера заместителей в ядре. Введение в бензольное ядро электроноакцепторных заместителей ( нитрогруппы, атомов галогенов и др.) приводит к увеличению кислотных свойств фенола. [4]
Кислотность фенолов уменьшается с введением алкильных групп. [5]
Кислотность фенолов зависит от характера заместителей в ядре. [6]
Кислотность фенола также довольно мала. Она может быть сильно повышена введением в ароматическую систему групп с большим эффектом поля и Е - эффектом, например трех нитрогрупп, что находит отражение и в названии соответствующего соединения - пикриновая кислота. [7]
Кислотность фенолов в пиридине возрастает до относительно более высокого уровня, чем кислотность карбоновых кислот. [8]
Увеличение кислотности фенолов при введении в ароматическое кольцо электроноакцепторных заместителей происходит очень резко в случае литро - и полинитросоединений. Такое увеличение кислотности для соединений ( IV), ( VII) и ( VI) связывают с наличием индуктивного и резонансного эффектов нитрогруппы. В случае м-нитрофенола ( V) ( р / С08 35) возрастание кислотности происходит лишь по индуктивному механизму. [9]
Различие в кислотности фенолов положено в основу ряда методов разделения смесей и в сочетании с другими методами широко используется при выделении природных продуктов. Следует отметить, что 3-ди - и р-трикетоны, которые содержатся в хмеле и различных эфирных маслах, имеют резко выраженную кислотность и до некоторой степени похожи на фенолы ( например, триацетилметан имеет рКа 5 81 [ ср. [10]
Разница в кислотности фенолов и тиофенолов довольно значительная. [11]
При рассмотрении кислотности фенолов положение несколько отличается от положения с ароматическими аминами. Более сильная стабилизация происходит у феноксид-иона вследствие большого мезомерного эффекта отрицательно заряженного атома кислорода; поэтому здесь следует ожидать результатов, качественно подобных найденным для аминов, а именно - кислотность должна уменьшаться при ингибировании мезомерии. [12]
 |
Потенциальные энергии ионизации циклогексинола ( а и фенола ( б. [13] |
Очевидно, что кислотность фенолов будет меняться в зависимости. [14]
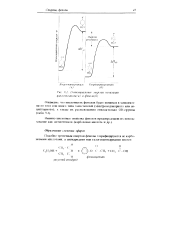 |
Потенциальные энергии ионизации циклогексанола ( а и фенола ( 6. [15] |
Страницы: 1 2 3 4