Константа - диссоциация
Cтраница 2
Константа диссоциации меняется с температурой, причем различно для различных кислот. [16]
Константы диссоциации и распределения тиоокси-на приведены в приложении. [17]
Константа диссоциации ( см. табл. 14) иона НСОз ( / С2 5 6 - 10-и) меньше константы диссоциации Н2СО3 ( / Ci 4 3 10 - 7) примерно в 8000 раз; во столько же раз сильнее протекает гидролиз по первой ступени, чем по второй. [18]
Константа диссоциации характеризует силу кислоты или основания: константа диссоциации у сильных кислот и оснований настолько велика, что они диссоциируют практически нацело; слабые кислоты и основания диссоциируют незначительно. Определяемые обычным путем константы диссоциации - постоянные величины лишь в данном растворителе, поэтому сила кислот и оснований сравнивается по значениям КА или Кв только для данного растворителя. Химическая природа характеризуется протонно-донорными и протонно-акцепторными свойствами растворителя и химическим взаимодействием молекул растворителя с молекулами и ионами кислоты или основания. Физическая характеристика связана прежде всего с диэлектрической постоянной растворителя, влияющей на энергию межионного взаимодействия. [19]
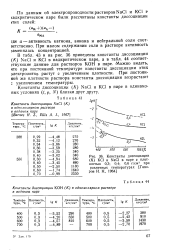 |
Константы диссоциации ( К КС1 и NaCl в паре с плотностью 0 3. 0 4. 0 6 г / см3 при различных температурах [ Говоров И. Н., 1964 ]. [20] |
Константы диссоциации ( К) NaCl и КС1 в паре в одинаковых условиях ( t, p, JV) близки друг другу. [21]
Константа диссоциации не зависит от разбавления твора электролита, поэтому в ряде случаев для определения силы электролита удобнее пользоваться константой диссоциации, а не степенью диссоциации. [22]
Константы диссоциации и измерения электропроводности имеют такое же значение, как всегда. Когда с водой реагирует достаточно сильная кислота, возрастает концентрация водородных ионов; когда с водой реагирует дЬстаточно сильное основание, возрастает концентрация гидроксильных ионов. В том или ином растворителе сила кислоты или основания в известных пределах может быть измерена их константой диссоциации. В литературе есть много примеров, поддерживающих этот вывод применительно к другим растворителям, кроме воды. [23]
Константы диссоциации тем больше, чем менее устойчиво данное соединение, чем больше оно распадается на составные части. В выражениях для констант диссоциации в числителе всегда стоят концентрации ( активности) продуктов распада данного соединения, в знаменателе - концентрации нераспавшихся сложных частиц. К константам этого типа принадлежат так называемые константы диссоциации кислот и оснований, ПР ( Ks) малорастворимых электролитов, ионное произведение воды, а также константы нестойкости комплексов, которые в настоящее время применяют мало. [24]
Константы диссоциации - К для слабых кислот или оснований находят в таблицах ( см. стр. [25]
Константы диссоциации, рассчитанные [14] по кривой нейтрализации свободной кислоты гидроокисью тетраметиламмония свидетельствуют о том, что ИДА является двухосновной кислотой Н2Х ( р & г 2 54, р &2 9 12), существующей в растворе в виде бетаина. [26]
Константа диссоциации, соответствующая отщеплению протона от первого бетаинового атома азота несимметричной 1 - ОПДТА, почти на полтора порядка отличается от соответствующей константы симметричной 2 - ОПДТА, что, видимо, является следствием прочной водородной связи между этим протоном в 1 - ОПДТА и расположенной рядом оксигруппой. В то же время несимметричность структуры 1 - ОПДТА проявляется в увеличении разницы между константами диссоциации первого и второго бетаиновых протонов по сравнению с константами симметричной 2 - ОПДТА. ДОБТА ( fc5 9 - Ю-12; k6 1 8 - 10 12) [34, 36, 37] - с известными оксикислотами, в частности с лимонной ( k3 10 - 16) [41] и винной ( Аз 1 13 - 10 - 14; &4 2 54 - Ю-16) [42, 43], показало, что атомы водорода оксигрупп в данных комплексонах обладают большей подвижностью. [27]
Константа диссоциации определяется экспериментально след, основными методами: 1) для к-ты - по зависимости эдс элемента, состоящего из водородного п хлорсеребряного электродов и содержащего изучаемую к-ту, ее соль п хлорид какого-нибудь металла, от концентрации; 2) по зависимости электропроводности р-ра от концентрации электролита. Подставляя в ур-ние для электропроводности вместо концентрации электролита произведение степени диссоциации на концентрацию, получают величину а и по приведенному выше выражению вычисляют К; 3) спектрофотометрическим методом. Спектры поглощения ионов и недиссоциированных молекул различаются длиной волны. По интенсивности полос, соответствующих данной частице, оценивается ее концентрация, а из соотношений концентраций вычисляется константа диссоциации. [28]
Константа диссоциации не пригодна для сравнения силы кислот в разных растворителях, в том числе в растворах кислот разной концентрации. [29]
Константы диссоциации хорошо согласуются с константами диссоциации соответствующих низкомолекулярных метакриловых кислот линейного строения. [30]
Страницы: 1 2 3 4