Область - концентрированный раствор
Cтраница 2
Наибольший интерес представляет использование участка кривой efg, лежащего в области концентрированных растворов, на котором можно получить более высокую чувствительность. [16]
Изотермы сорбции оппанола и вистанекса очень близки друг другу в области концентрированных растворов, что объясняется тем, что в этой области эквивалентными единицами являются малые отрезки цепи. В концентрированных растворах не сказывается разница в молекулярных весах для полимеров высокого молекулярного веса. [17]
В системе же этанол - этила-цетат ( 2) линия азеотропов идет при низких температурах в области концентрированных растворов ( по-видимому, она доходит до температуры замерзания) и заканчивается на оси чистого этанола, далеко не доходя до критических параметров системы. [18]
Вязкость серной кислоты, как и всякой жидкости, уменьшается с повышением температуры, особенно значительно в области концентрированных растворов. Для олеума максимум кривой вязкости соответствует 55 - 60 % SO3 ( своб), далее наблюдается незначительное ее понижение. [19]
Согласно формуле (V.11) при малых значениях параметра Е значение 0G J f 0M / cT, а в области концентрированных растворов и расплавов высокомолекулярных полистиролов 6G L т) 0 / с2Т, что качественно верно передает тенденцию ряда серий экспериментальных данных. [20]
Единственное преимущество дилатометрического метода по сравнению с хроматографическим, по нашему мнению, состоит в том, что в области концентрированных растворов его применение в простых случаях дает возможность определить степень превращения мономера с большей точностью, особенно при малых степенях превращения. [21]
В классической работе О зависимости между температурой плавления твердых тел и их растворимостью в жидкостях И. Ф. Шредер впервые показал возможность применения к области концентрированных растворов новых методов термодинамического исследования, которые тогда только что были положены Вант-Гоффом в основу теории разбавленных растворов. [22]
В работе [2] при исследовании мембран с разным содержанием такого нейтрального комплексообразователя, как валиномицин в растворах хлористого калия экспериментально обнаружен немонотонный характер отклонений от калиевой функции мембран в области концентрированных растворов. Этот факт объясняется авторами в значительной мере проявлением эффекта сопряженного переноса ионов калия и вали-номшшна для мембран со средними концентрациями лиганда. [23]
Успехам в расшифровке механизма кислотно-каталитических превращений в жидкой фазе способствовало два обстоятельства: 1) в последние 10 - 15 лет особенно тщательному количественному исследованию был подвергнут катализ в области концентрированных растворов кислот. [24]
Сопоставление с выводом термодинамических уравнений в теории квазирегулярных растворов ясно показывает, что введение конфигурационного вклада в избыточную энергию Гиббса улучшает модель раствора и делает ее более реалистичной, особенно в области концентрированных растворов. Для разбавленных растворов конфигурационный вклад очень мал, и результаты этой модели и теории квазирегулярных растворов практически совпадают между собой. [25]
Для получения кривых зависимости ДЯ / ( со) 2 ( типа кривых рис. 145) интегральные теплоты растворения в области разбавленных растворов определяются обычным способом ( разбивание ампулы с навеской полимера в растворителе), а в области концентрированных растворов теплоты растворения рассчитывают по закону Гесса. [26]
 |
Цолитермичоская диаграмма пределов существования. [27] |
Политермическая диаграмма тройной системы LiOH - Н202 - Н2О характеризуется наличием восьми полей, отвечающих вышеуказанным твердым фазам: льду, LiOH Н20, Li202 Н20, Li202 Н202 ЗН20, Li202 Н202 2Н20, Li202 2Н202, а также области концентрированных растворов Н202, твердой Н202 и не исследованной нами области, лежащей ниже эвтектической точки лед-1 - LiOH Н20 при - 18 С, обозначенной на диаграмме рис. 1 треугольным значком. [28]
 |
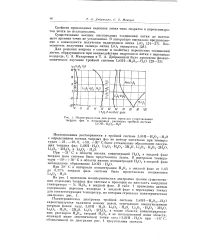
Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации. [29] |
В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением количества ионов, переносящих электричество. В области концентрированных растворов повышение концентрации сопровождается увеличением вязкости раствора, что снижает скорость движения ионов и электрическую проводимость. Кроме того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, количество ионов, переносящих электричество. [30]
Страницы: 1 2 3 4