Область - концентрированный раствор
Cтраница 3
Таким образом, представление о возможности сведения кислотного катализа к катализу ионами хотя и имеет основание, однако доказательства ограничены узким экспериментальным материалом в виде работ из области разбавленных растворов. Катализ в области концентрированных растворов явно противоречит такому представлению. Тем не менее, когда появились факты о каталитическом действии кислот, находящихся на поверхности, то были склонны рассматривать подобный тип гетерогенного катализа как доказательство возможности ионной активации на поверхности, хотя до сих пор остается неясным вопрос о том, в какой форме присутствует кислота в межфазовом пространстве. Из изложенного ясно, что если основная сущность кислотного катализа остается одной и той же вне зависимости от условий, в которых он проявляется ( для этого предположения уже теперь имеется достаточно данных), то она не может быть сведена к активирующему действию ионов, и, следовательно, кислотный катализ должен быть рассмотрен в ином аспекте. [31]
Компонент, мольная доля которого близка к единице, обычно считают растворителем. В промежуточной области ( область концентрированных растворов) не соблюдаются ни закон Рауля, ни закон Генри, а оценку коэффициента Лг, обычно сильщэ зависящего от концентрации, производят по экспериментальным данным. К сожалению, многие растворы, применяемые для выращивания кристаллов, достаточно концентрированы. Поэтому часто рискованно проводить расчеты на основе предположения о слабом взаимодействии между частицами растворенного вещества. [32]
В силу условия Л поведение полуразбавленных растворов достаточно универсально для широкого - класса полимеров, что и позволяет выделить их в самостоятельную область. Более высоким концентрациям отвечает область концентрированных растворов. [33]
Наблюдается два типа равновесия газ - газ. В одном из них это равновесие начинается в области концентрированных растворов. [34]
Пунктирная кривая соответствует данным для 20, причем но оси абсцисс вместо т отложено с. Такая замена единиц концентрации мало отражается на кривизне в области концентрированных растворов. [35]
Пунктирная кривая соответствует данным для 20, причем по оси абсцисс вместо т отложено с. Такая замена единиц концентрации мало отражается на кривизне в области концентрированных растворов. [36]
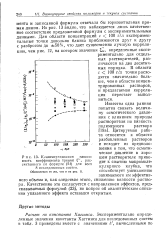 |
Концентрационная зависимость коэффициента трения., рассчитанного по формуле ( 23 для всех. [37] |
Из рис. 13 видно, что наблюдается лишь качественное соответствие предложенной формулы с экспериментальными данными. В области с 100 г / л точки расходятся значительно больше, чем в области концентрированных растворов, и предлагаемая корреляция перестает выполняться. [38]
Представления об образовании иояно-ассоциатных комплексов применяются в экстракционном разделении, основанном на распределении компонента в системе жидкость - жидкость. Использование теоретических значений ( & ассоц) а в аналитической - химии весьма затруднительно, ибо для области довольно концентрированных растворов электролитов, в которой образуются ионно-ас-социатные комплексы, значения коэффициентов активности, как правило, не известны. В таких растворах коэффициенты активности сильно зависят от концентрации и природы ионов. [39]
Этому отвечает выпуклая кривая на рис. 9, д, охватывающая всю область составов. Если Т Tg, то в области разбавленных растворов система полимер - растворитель представляет собой вязкую жидкость, а в области концентрированных растворов или пластифицированных полимеров система полимер - растворитель находится в стеклообразном состоянии. [40]
Этому отвечает выпуклая кривая на рис. 9, д, охватывающая всю область составов. Если Т; Т & то в области разбавленных растворов система полимер - растворитель представляет собой вязкую жидкость, а в области концентрированных растворов или пластифицированных полимеров система полимер - растворитель находится в стеклообразном состоянии. [41]
Однако до сих пор еще не существует достаточно строгой теории, которая позволила бы количественно предсказать зависимость среднего коэффициента активно сти электролита от концентрадии в области концентрированных растворов. [42]
 |
Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации. [43] |
Поэтому для точных измерений электрической проводимости необходимо термостатирование растворов. Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации представлена на рис. 10.1. В разбавленных растворах сильных электролитов ( H2SO4, НС1, КОП, NaOH) рост электрической проводимости с концентрацией обусловлен увеличением количества ионов. Однако в области концентрированных растворов одновременно с ростом концентрации ионов увеличиваются и силы электростатического притяжения между ионами, что приводит к уменьшению скорости движения ионов. При определенном значении концентрации влияние уменьшения скорости движения ионов начинает преобладать над влиянием увеличивающейся ионной концентрации. В результате этого х уменьшается. [44]
Однако при помощи уравнения ( XI-3) невозможно объяснить наблюдаемое на опыте изменение емкости с потенциалом и с концентрацией ионов в растворе. Теория Гельмгольца, таким образом, не может удовлетворительно истолковать основные экспериментальные закономерности, связанные со строением двойного слоя, поэтому ее нельзя считать совершенной. Однако в ряде случаев, особенно в области концентрированных растворов электролитов, она приводит к выводам, согласующимся с опытом, и, следовательно, в какой-то мере правильно отражает истинную картину строения двойного электрического слоя. [45]
Страницы: 1 2 3 4