Сиджвик
Cтраница 4
Хотя мы и хотели бы сохранить простоту модели Сиджвика, нужно признать, что она требует усовершенствования не только из-за возражений, на некоторые мы только что указывали, но и по ряду других причин, которые станут очевидны ниже. [46]
Металлы с нечетными порядковыми номерами не могут удовлетворять правилу Сиджвика в нейтральных комплексах с лигандами СО, поскольку получается нечетное число электронов. Однако правило может стать выполняемым, во-первых, при добавлении одного электрона с образованием аниона [ М ( СО) л ] -, во-вторых, при введении второго нейтрального ли-ганда с неспаренным электроном, например, атома водорода или хлора - [ М ( СО) ПН ] или [ М ( СО) С1 ], и наконец, в-третьих, в отсутствие других лигандов - при димеризации комплекса с нечетным числом электронов. [47]
Ранее этот вопрос рассматривался [12, 192] обычно на основании выводов Сиджвика из данных препаративной химии. Данных по константам устойчивости для лигандов, содержащих тяжелые атомы подгрупп VB и VIB периодической системы, пока еще мало, так как эти лиганды часто самопроизвольно окисляются на воздухе, нерастворимы в воде или обладают скверным запахом. Атомы, непосредственно координирующиеся с ионами металлов в одноядерных комплексах ( в виде отдельных атомов или групп), перечислены в табл. И. [48]
Основы новой теории были заложены в 1940 г., когда Сиджвик ir Пауэлл20 сделали обзор стереохимии известных тогда неорганических соединений и заключили, что пространственное распределение связей для многовалентных атомов непосредственно связано с общим числом электронов валентного электронного уровня. Они предположили, что электронные пары, находящиеся в валентном уровне многовалентного атома, расположены всегда так, что отталкивание между ними минимально, независимо от того, являются ли они поделенными ( связывающими) парами или неподеленными ( несвязывающими или свободными) парами. [49]
Основы новой теории были заложены в 1940 г., когда Сиджвик и Пауэлл20 сделали обзор стереохимии известных тогда неорганических соединений и заключили, что пространственное распределение связей для многовалентных атомов непосредственно связано с общим числом электронов валентного электронного уровня. Они предположили, что электронные пары, находящиеся в валентном уровне многовалентного атома, расположены всегда так, что отталкивание между ними минимально независимо от того, являются ли они поделенными ( связывающими) парами или неподеленными ( несвязывающими, или свободными) парами. В соответствии с этим предположением две пары будут располагаться линейно, три - в плоском треугольнике, четыре - тетраэдрически, пять - в виде тригональной бипирамиды и, наконец, шесть пар - окта-эдрически. Оказалось, что указанные конфигурации, объясненные таким простым способом, правильно предсказывают формы молекул во всех известных соединениях непереходных элементов, если в этих соединениях все электронные пары валентного уровня соединены с идентичными атомами или группами. Если одна или более электронных пар не поделены или если имеется два или более разных вида присоединенных атомов, то следует ожидать отклонений от геометрически правильных структур. Одной из наиболее ценных идей, которая, по-видимому, должна быть введена в стереохимию вслед за первыми применениями теории валентной связи, является утверждение, что при определении структур молекул соединений непереходных элементов неподеленные, или свободные пары электронов так же важны, как и связывающие пары. Однако следует отметить, что при определении стереохимии соединений переходных элементов свободные пары, вероятно, не играют такой же роли, как в случае непереходных элементов. [50]
Основы новой теории были заложены в 1940 г., когда Сиджвик и Пауэлл20 сделали обзор стереохимии известных тогда неорганических соединений и заключили, что пространственное распределение связей для многовалентных атомов непосредственно связано с общим числом электронов валентного электронного уровня. Они предположили, что электронные пары, находящиеся в валентном уровне многовалентного атома, расположены всегда так, что отталкивание между ними минимально, независимо от того, являются ли они поделенными ( связывающими) парами или неподеленными ( несвязывающими или свободными) парами. В соответствии с этим предположением две пары будут располагаться линейно, три - в плоском треугольнике, четыре-тетраэдрически, пять - в виде тригональной бипирамиды и, наконец, шесть пар - октаэдр ически. Оказалось, что указанные конфигурации, объясненные таким простым способом, правильно предсказывают формы молекул во всех известных соединениях непереходных элементов, для которых все электронные пары валентного уровня соединены с идентичными атомами или группами. Если одна или более электронных пар не поделены или если имеется два или более разных видов присоединенных атомов, то следует ожидать отклонений от геометрически правильных структур. [51]
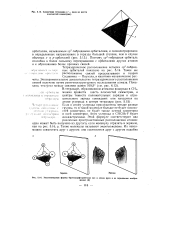 |
Симметрия тетраэдра ( 7 - одна из шести плоскостей симметрии.| Энантиоиерные формы бромхлорфторметана ( а и левая рука и ее зеркальное изображение ( б. [52] |
Такое же коричные р6и мм расположение связей предсказывают и теория Сиджвика - Пауэлла, и квантово-механические расчеты. Экспериментальное доказательство тетраэдрического расположения связей получено путем рентгеноструктурного исследования алмаза. [53]
Отметим, что этот вывод был сделан без произвольных допущений Сиджвика относительно величины эффективного атомного номера лишь на основании ( правда, весьма приближенного) волново-меха-нического анализа собственных функций электронов. [54]
Отметим, что этот вывод был сделан без произвольных допущений Сиджвика относительно величины эффективного атомного номера лишь на основании ( правда, весьма приближенного) волново-меха-нического анализа собственных функций электронов. Чтобы иметь возможность хотя бы подойти к пониманию этих результатов, необходимо привести еще некоторые дополнительные данные. [55]
Страницы: 1 2 3 4