Скорость - реакция
Cтраница 3
Скорость реакций для незамещенных альдегидов имеет промежуточные значения. [31]
Скорость реакции определяет процесс диффузии кислорода от границы раздела фаз в жидкость. Однако диффузия углеводородов и продуктов реакции в фазе 2 оказывает большее влияние на процесс окисления. Значительное уменьшение продолжительности окисления и содержания кислорода в газообразных продуктах окисления возможно [369, 491] при появлении свежей поверхности фазы 2 ( сырья, битума) с достаточным содержанием реакционноспособных углеводородов, например би - и полициклических ароматических соединений. Измельчением пузырьков можно увеличить скорость диффузии кислорода. Чем выше удельная поверхность, тем лучше распределяется воздух и быстрее уменьшается объем, а также парциальное давление кислорода. Однако с повышением степени измельчения пузырьков при помощи мешалки затраты энергии резко возрастают. При распределении воздуха соплами необходимая энергия для измельчения пузырьков сообщается в виде давления. Для повышения степени измельчения необходимо увеличить давление сжатого воздуха. Размеры пузырьков и их удельная поверхность изменяются в течение существования пузырьков вследствие разогрева, изменения статического давления, обратной диффузии, коагуляции. Расчет этих изменений сложен. [32]
Скорость реакции ( 3) возрастает следствие увел1ичения по верхности соприкосновения пленки ( из-за неравномерности ее растворения) с раствором электролита. Следовательно, в процессе анодного оксидирования алюминия скорость роста плевки уменьшается, а скорость ее растворения увеличивается. [33]
Скорость реакции определяет процесс диффузии кислорода от границы раздела фаз в жидкость. Однако диффузия углеводородов и продуктов реакции в фазе 2 оказывает большее влияние на процесс окисления. Значительное уменьшение продолжительности окисления и содержания кислорода в газообразных продуктах окисления возможно [369, 491] при появлении свежей поверхности фазы 2 ( сырья, битума) с достаточным содержанием реакционноспособных углеводородов, например би - и полициклических ароматических соединений. Измельчением пузырьков можно увеличить скорость диффузии кислорода. Чем выше удельная поверхность, тем лучше распределяется воздух и быстрее уменьшается объем, а также парциальное давление кислорода. Однако с повышением степени измельчения пузырьков при помощи мешалки затраты энергии резко возрастают. При распределении воздуха соплами необходимая энергия для измельчения пузырьков сообщается в виде давления. Для повышения степени измельчения необходимо увеличить давление сжатого воздуха. Размеры пузырьков и их удельная поверхность изменяются в течение существования пузырьков вследствие разогрева, изменения статического давления, обратной диффузии, коагуляции. Расчет этих изменений сложен. [34]
Скорость реакций в данном случае определяется многими факторами: химическими н физическими свойствами окислов, поверхностью соприкосновения взятых веществ, температурой прокалпваппя. Чем больше различаются окислы в отношении основности - кислотности, чел больше степень измельчеппя материала и чем выше температура прокаливания, тем быстрее протекает реакция. Окислы, взятые для реакции, нужно смочить водой и очень тщательно ( иногда ото требует нескольких часов) растереть в тонкий порошок. Прокаливать исходную смесь нужно при возможно более высокой температуре, однако ниже температуры плавления исходных веществ. Если соли имеют высокую температуру плавления, то для получения их в впдс плотной массы исходную смесь окислов после перемешивания н растирания прессуют под большим давлением, а затем спекают. [35]
Скорость реакции изменяется в очень широких пределах в зависимости от природы ароматических углеводородов. [36]
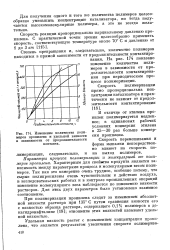 |
Изменение количества полимеров пропилена и удельной вязкости в зависимости от продолжительности контакта. [37] |
Скорость реакции пропорциональна парциальному давлению пропилена. [38]
Скорость реакции существенно зависит также от присутствия катализатора и реакционной способности углеродистого материала: наибольшей активностью обладают древесный уголь и малозольный торфяной кокс. [39]
Скорость реакции в целом определяется скоростью первой элементарной стадии. [40]
Скорость реакции лимитируется скоростью наиболее эндотермической стадии. [41]
Скорости реакций ( а) и ( б) могут быть очень различными. Если скорость реакции ( б) намного больше, чем скорость реакции а), то железо, очевидно, всегда находится в трехвалентном состоянии, в противном случае - в двухвалентном. [42]
Скорость реакции и выходы алкилортоформиатов в отсутствие кислоты резко падают. [43]
Скорость реакции жидкофазно-го окисления топлива, определяемая по количеству поглощенного кислорода, зависит от концентрата кислорода в газовой фазе ( ряс. [44]
Скорость реакции зависит от количества воды в диметилсульфоксиде. Кроме того, в условиях реакции тетрагидроиндол способен присоединиться к ацетилену с образованием 1-винилпроизводного. Поэтому ход реакции целесообразно контролировать с помощью ГЖ - или ТС-хроматографии. Типичные условия ГЖ-хроматогра-фироваиия: хроматограф Хром-5, детектор ионизационнопламенный, температура испарителя 260 С, температура колонки 102 С, температура детектора 260 С, длина колонки 1200 мм, диаметр 3 мм - фаза - 5 % - ный ХЕ-60, носитель. N-AW силанизированный, расход воздуха 500 мл / мин, водорода - 28 мл / мин, гелия - 30 мл / мин. Типичные условия ТС-хроматограмм: силуфол UV-254, гексан - эфир ( 1: 1), проявитель - пары йода. [45]
Страницы: 1 2 3 4