Электрохимическая стадия
Cтраница 2
Скорость электрохимической стадии - скорость разряда - в значительной мере определяется перенапряжением, зависящим от металла, на котором происходит разряд. На металлах Hg, Pb, Tl, Zn, Sn перенапряжение велико; на металлах Pt и Ru перенапряжение водорода мало. [16]
 |
Кривые потенциал-плотность тока при концентрационной поляризации с перемешиванием ( 7 и без перемешивания ( 2. [17] |
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации. [18]
 |
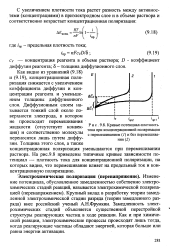
Зависимость электрохимической поляриза ции электрода от lg (. [19] |
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая выше среднего уровня энергии молекул. Разность между энергией реагирующей частицы и средней энергией молекулы называется энергией активации. Частицы, энергия которых больше или равна энергии активации, называются активными. Только активные частицы способны к эффективному взаимодействию на электроде. Скорость электрохимических реакций, как и химических реакций, может быть увеличена повышением температуры и применением катализатора. При повышении температуры растет доля активных молекул, при применении катализатора снижается энергия активации. [20]
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации. [21]
В электрохимической стадии процесса может протекать только эквивалентное окисление компонентов сплава, так как поверхностные слои более медленно окисляющегося компонента будут защищать более глубокие слои менее благородного компонента. Переход же в раствор ионов обоих компонентов определяется несколько иными факторами - для палладия это будет скорость растворения окисной пленки в цианистых растворах, которая несколько замедлена и протекает с несколько большей энергией активации. Это, в частности, подтверждается и пониженными концентрациями палладия в растворе по сравнению с концентрациями серебра. [22]
Когда медленной электрохимической стадии предшествует обратимая химическая стадия, то влияние последней на вольтамперную кривую легко учесть. [23]
Протекание электрохимической стадии коррозионного процесса затормаживается после значительного накопления на анодных участках окислов железа, затрудняющих доступ электролита к металлу. Электрохимическое воздействие окислов трехвалентного железа на металл может происходить лишь в местах обнажения его в результате растрескивания находящихся на анодах пленок. Дальнейшее же разрушение металла ( химическая стадия ракушечной коррозии) происходит в основном за счет химического воздействия на него водяного пара, образующегося в зоне перегретого металла. [24]
Если собственно электрохимическая стадия процесса необратима, то потенциал электрода определяется уже не отношением приэлектродных концентраций окисленной и восстановленной форм, а кинетикой переноса электронов. [25]
Если скорость электрохимической стадии ( переноса электронов, реакции перехода) меньше скорости диффузии деполяризатора, электродный процесс контролируется скоростью переноса заряда. [26]
Константа скорости электрохимической стадии зависит от скачка потенциала в плотной части двойного электрического слоя ( ДЭС), расположенной между центром реагирующей частицы и поверхностью металла. Изменения указанного скачка потенциала равны изменению разности Е - tylt где Е - общий скачок потенциала на границе раздела металл - раствор, измеренный относительно некоторого постоянного электрода сравнения, а г - скачок электрического потенциала между толщей раствора и точкой, в которой находится участвующая в электрохимической стадии частица. [27]
Если в электрохимической стадии участвуют специфически адсорбированные комплексы, то связь между их поверхностной концентрацией и концентрациями комплексов в объеме раствора, с которыми они находятся в равновесии, определяется константами равновесия соответствующих гетерогенных химических реакций. [28]
Если же электрохимической стадии предшествует медленная химическая реакция, в результате которой образуются электрохимически активные частицы, то наблюдаются так называемые кинетические токи. [29]
Если в электрохимической стадии одновременно участвуют z электронов, то 3 fiz, где р - истинный коэффициент переноса анодного процесса. [30]
Страницы: 1 2 3 4