Теория - переходное состояние
Cтраница 4
Однако теория переходного состояния в принципе не дает оснований для такого разграничения, а равная применимость принципа линейной зависимости свободных энергий к скоростям и равновесиям показывает, что оно не является необходимым. [46]
Согласно теории переходного состояния, переходное состояние реакции можно рассматривать как псевдомолекулярную частицу, обладающую всеми свойствами, присущими молекулам вещества, и находящуюся в равновесии с исходными реагентами. [47]
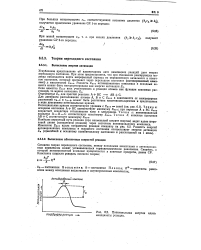 |
Потенциальная энергия вдоль координаты реакции. [48] |
Согласно теории переходного состояния, между исходными веществами и активированным комплексом может устанавливаться термодинамическое равновесие. [49]
В теории переходного состояния скорость реакции связана с давлением следующим образом. Теплота активации Д Н в уравнении ( 8) может быть заменена суммой ( Д Е Р &. V), где Д Е - разность внутренних энергий между основным состоянием и переходным состоянием [ не следует смешивать с А Е в уравнении ( 7) Аррениуса ] и Д V - разность объемов между основным и переходным состояниями. [50]
Согласно теории переходного состояния скоростей реакций [13], зная некоторые свойства активированного комплекса, можно удовлетворительно определить скорость химической реакции. Активированный комплекс представляет собой агрегат нескольких реагирующих молекул, имеющий конфигурацию, соответствующую максимальной потенциальной энергии, и существующий при переходе реакции через потенциальный барьер. Та область сближения реагирующих молекул, в которой энергия максимальна, называется переходным состоянием; активированный комплекс существует в переходном состоянии. Чем меньшая энергия требуется для образования активированного комплекса, тем, как правило, быстрее происходит реакция, хотя иногда особые факторы, не связанные с энергией, могут замедлять реакцию. Таким фактором может быть энтропия активации А5, являющаяся разностью энтропии активированного комплекса и реагирующих веществ. [51]
Применение теории переходного состояния указывает на значительное возрастание энергии активации с увеличением числа химических связей между макромолекулами. [52]
Следовательно, теория переходного состояния в первом приближении весьма просто решает проблему мономолекулярных реакций. [53]
Так в теории переходного состояния устанавливается связь между кинетическими ( k) и термодинамическими ( К) величинами. [54]
Доказательство в теории переходного состояния того факта, что скорость реакции зависит не только от энергии активации, но и от энтропии активации, позволяет объяснить различие в скоростях реакций с близкими величинами энергии активации. [55]
Страницы: 1 2 3 4