Фермент
Cтраница 3
Ферменты этой группы катализируют перенос атомных группировок одного соединения на другое, например, аминоферазы производят переаминирова-ние; фосфоферазы катализируют перенос остатков фосфорной кислоты. [31]
Ферменты, которые осуществляют реакции основного и конструктивного метаболизма, высокоспецифичны и, как правило, конститутивны. Ферменты подготовительного метаболизма относятся в основном к индуктивным ферментам и намного менее специфичны. Это способствует вовлечению в микробные реакции самых разнообразных соединений, в частности и таких, которые ранее в природе не встречались. [32]
Фермент не индуцируется в присутствии арилсуль-фоната. [33]
Ферменты, катализирующие окисление путей4 отщепления водорода от питательного субстрата ( дегидразы), имеют белковую природу и чрезвычайно чувствительны к биологическим ядам. [34]
Ферменты обладают очень высокой каталитической активностью. Некоторые ферментные системы настолько специфичны, что способны катализировать превращения одного-единственного вещества, причем трансформируют только одну группу атомов, да еще и направленно в трехмерном пространстве. [35]
Ферменты, необходимые для этих реакций, по-видимому, являются общими для грибов. Однако только для биоокисления агрокЛавина ( с использованием Psilocybe semperviva) до сетоклавина был приведен выход. Так как агроклавин может окисляться и химически ( бихроматом) с образованием сетоклавина ( выход 38 %) и изосетоклавина ( выход 13 %), то микробиологический метод может быть полезным только для тех клавиновых субстратов, для которых химическое окисление осуществить не удается. [36]
Фермент гомогенен при электрофорезе в полиакриламидном геле ( рН 8 9 и 4 3) и при рехроматографии на сефадсксс G-75. Молекулярный вес фермента по результатам гель-фильтрации равен 24500 1000; трипсиновая активность, определенная по методу Шверта и Та-кенака, - 3500 ед / мг. [37]
Ферменты, или энзимы, являются биологическими катализаторами, ускоряющими химические процессы обеспечения жизнедеятельности любых организмов. Все ферменты относятся к белкам, и их разделяют на два типа: вещества чисто белковой природы и соединения, в которых белковая часть связана с небелковыми компонентами - коферментами. В качестве кофермента могут выступать простетические группы, входящие в состав фермента - протеида, либо другие низкомолекулярные органические соединения, чаще всего витамины, связанные с белком в комплекс. В последнем случае биологическая активность белковой структуры проявляется только в соединении с небелковой частью молекулы. [38]
Фермент, способный расщеплять карбамид на H3N и СО2 Он всречается в сое и нек-рых др. бобовых. [39]
Ферменты являются катализаторами реакций, протекающих в живой материи. В настоящее время многие ферменты выделены в виде чистых кристаллических веществ. Оказалось, что некоторые из этих кристаллических ферментов являются чистыми протеинами; таковы пепсин - один из протеолитических ферментов, катализирующий гидролиз пептидной связи ( - СО - NH -) в протеинах, и уреаза, катализирующая гидролиз мочевины. Другие ферменты содержат, помимо самого протеина, простетическую группу, существенную для каталитической активности; часто про-стетическая группа представляет собой флавин, как в различных ферментах, катализирующих окислительно-восстановительные реакции, или гематин, как в каталазе или пероксидазах, катализирующих некоторые реакции перекиси водорода. Некоторые другие ферменты активны только тогда, когда, помимо субстрата, присутствует кофактор. Кофактор, подобно ферменту, принимает участие в катализируемой ферментом реакции, однако он не разрушается; он может иметь простое химическое строение типа неорганического иона, и тогда его называют активатором, или же представлять сложную органическую молекулу, известную под названием кофермента. Кофакторы, по-видимому, действуют подобно простетическим группам ( или части таких групп), которые легко отделимы от фермента. Хотя различие между кофакторами и про-стетическими группами в пределах фермента имеет важное значение с точки зрения биологии, оно может быть весьма искусственным, когда речь идет о механизме катализа. [40]
Ферменты были очищены в 35 - 40 раз, однако все же не были гомогенными и при электрофорезе давали три белковых компонента. [41]
 |
Уровни энергии боковые цепи ориентируются перпендику. [42] |
Ферменты известны в кристаллическом состоянии, в котором расположение их молекул очень упорядочено. В частице коллоидного ра-створа такая упорядоченность в значительной степени нарушается, но, по-видимому, для отдельных частей макромолекул белка она частично сохраняется, так что атомы этой молекулы входят в выемки другой. [43]
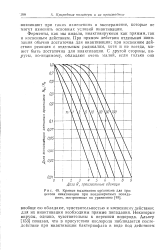 |
Кривые выживания организма для процессов инактивации при неоднократных попаданиях, построенные по уравнению. [44] |
Ферменты, как мы видели, инактивируются как прямым, так и косвенным действием. При прямом действии отдельная ионизация обычно достаточна для инактивации; при косвенном действии реакция с отдельным радикалом, хотя и не всегда, может быть достаточна для инактивации. [45]
Страницы: 1 2 3 4