Давление - пар - насыщенный раствор
Cтраница 2
На рис. 50 приведено давление пара насыщенных растворов в системе Na2SO4 - NaOH - Н2О по разрезам с постоянным отношением количеств Na2SO4 и NaOH. Так же как и в системе NaGl - NaOH, при увеличении содержания NaOH в сухом остатке давления пара растворов и максимальные давления пара растворов, насыщенных Na2SO4, быстро уменьшаются. [16]
Аналогичный характер температурной зависимости давления пара насыщенных растворов легкоплавких и относительно тугоплавких солей объясняется тем, что в обоих случаях при повышении температуры концентрация насыщенных водных растворов непрерывно возрастает, доходя до 100 % - ного содержания солей при температурах их плавления. [17]
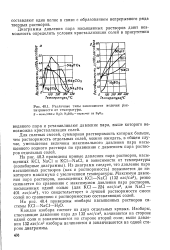 |
Различные типы зависимости величин растворимости от температуры. S-лолб / ЮООг Н2О. НзВОз - пересчет на. [18] |
Из диаграмм следует, что давление пара насыщенных растворов ( как и растворимость) повышается до некоторого максимума с увеличением температуры. [19]
В двойных системах соль-вода кривая давления пара насыщенных растворов ( рис. 33) ограничивает область сосуществования кристаллической соли с водяным паром; области, расположенные левее, правее и выше этой кривой, соответствуют ненасыщенным растворам соли в присутствии пара. Сопоставление таких кривых с кривой давления пара чистой воды непосредственно указывает для данного давления тот температурный интервал, в котором может существовать ненасыщенный раствор данной соли. [20]
Эти условия определяются изучением растворимости и давления пара насыщенных растворов в соответствующих водно-солевых системах. Получаемые в результате такого изучения физико-химические диаграммы указывают равновесные состояния системы при различных параметрах, а также выявляют общие закономерности кристаллизации солей при изменениях параметров. [21]
Давление паров жидкого аммиака значительно выше давления паров насыщенных растворов карбамида в жидком аммиаке ( ср. [22]
Давление паров жидкого аммиака значительно выше давления паров насыщенных растворов карбамида в жидком аммиаке. [23]
 |
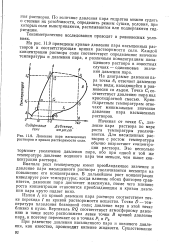
Схематическое изображение кривых р-х Ац. я установления концентрации и давления пара насыщенных растворов в системах 1-го типа. [24] |
С помощью этих методик устанавливались: давление пара ненасыщенных и насыщенных растворов; растворимость солей в присутствии паровой фазы; растворимость солей во флюидной фазе; температуры и давления, отвечающие сосуществующим растворам в верхних трех - и двухфазной областях; параметры, соответствующие точке Q. Реально полученные при исследовании фазовых равновесий кривые приводятся в главах III-V при описании соответствующих систем. [25]
 |
Давление пара насыщенных растворов и кривая растворимости соли. [26] |
Вначале рост температуры имеет преобладающее значение и давление пара насыщенного раствора увеличивается несмотря на повышение его концентрации. В дальнейшем рост концентрации нивелирует рост температуры; когда влияние обоих факторов сравняется, давление пара достигнет максимума, после чего влияние роста концентрации становится преобладающим и кривая давления пара круто падает вниз. [27]
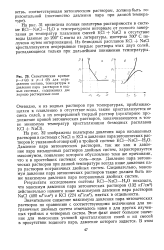 |
Схематические кривые р-х ( а и р - t ( б для определения состава, температуры и давления пара растворов в водных системах, содержащих две хорошо растворимые соли. [28] |
Давление пара эвтонических растворов, так же как и давление пара насыщенных растворов двойных систем, характеризуется максимумом, появление которого обусловлено теми же причинами, что и в простейших системах соль-вода. [29]
В табл. 5 приведены наши и литературные данные о давлении пара насыщенных растворов сернокислого аммония. [30]
Страницы: 1 2 3 4 5