Делокализация - электрон
Cтраница 4
Поскольку делокализация электронов всегда стабилизует систему, ясно, что локализация электронов делает систему менее прочной. Часто присоединение протона к основанию при образовании сопряженной кислоты сводится к ограничению электронной пары, которая в свободном основании была способна распространяться на ненасыщенную систему. Примером служит протонирование карбоксилат-аниона. Присоединение протона частично локализует электронную пару и нарушает симметрию данного иона. И все же кислота обладает некоторой энергией делокализации в силу того, что неподеленные электроны у кислорода гидроксильной группы перекрываются с л-орбитами карбонильной группы. [46]
Из-за делокализации электронов, характерной для СОХ-группы в кислотах и их производных, - 7 - и - М - эффекты карбонильной группы для производных кислот несколько модифицируются, но тем не менее эта группа сохраняет свое дезактивирующее и лшгш-ориентирующее влияние на связанное с ней ароматическое кольцо. Гораздо более важным является то, что подобная делокализация влияет на легкость взаимодействия карбонильного углерода с нуклеофилом как в результате изменения его положительного характера ( гетероатом несколько компенсирует частичный положительный заряд), так и по той причине, что образование связи с нуклеофилом будет разрушать устойчивость системы, обеспечиваемую делокализацией заряда. Эта делокализация максимальна для карбоксилат-аниона, поэтому карбонильный углерод этой группы оказывается очень мало склонным к взаимодействию с нуклеофилом. Поскольку еще более интенсивная делокализация происходит, если углеводородный остаток является ароматическим, то нукле-офильное присоединение к карбонилу, связанному непосредственно с ароматическим кольцом, затруднено в максимальной степени. [47]
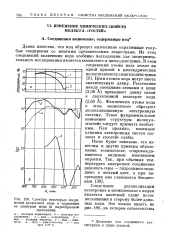 |
Спектры некоторых соединений включения иода в сравнении со спектром иода ( в парообразном состоянии. [48] |
Следствием делокализации электронов в комплексах с иодом является заметный сдвиг полос поглощения в сторону более длинных волн. [49]
Степень делокализации электрона часто можно определить также по двум другим эффектам. Первый из них связан с тем, что если неспаренные электроны не локализованы на атоме металла, то константа спин-орбитального взаимодействия уменьшается, так что - тензор становится менее анизотропным, чем при отсутствии ковалентной связи. [50]
Учет делокализации электронов приводит к деформации кривых, как показано сплошной линией. Величина ДБ ( рис. 54) представляет энергию резонанса ( энергию сопряжения) в переходном состоянии. [51]
Учет делокализации электронов приводит к деформации кривых, как показано сплошной линией. Величина Де ( рис. 54) представляет энергию резонанса ( энергию сопряжения) в переходном состоянии. [52]
В диарилкетонах делокализация электронов облегчает образование карбанионной структуры. [53]
Как влияет делокализация электронов на строение карбоксильного иона. Где находится отрицательный заряд после ионизации карбоновой кислоты. [54]
Сопряжение - делокализация электронов, осуществляемая за счет бокового перекрывания я - или р-орбиталей заместителя с л-орбиталями связей цепи или ароматического кольца. [55]
Как влияет делокализация электронов на расстояние между электронными энергетическими уровнями. Почему из этого следует, что многие из молекул с делокализованными электронами должны иметь видимую окраску. [56]
Страницы: 1 2 3 4